题目内容
右图为元素周期表短周期的一部分.关A~F六种元素的叙述正确的是( )
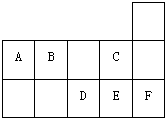

| A、A、B、D、E四种元素所形成的最高价含氧酸中D酸性最强 |
| B、形成的简单阴离子半径:C>B>D>E |
| C、D、E、F形成的单质都是双原子分子 |
| D、A与E形成的分子是一种常见有机溶剂 |
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:根据元素在周期表中的位置知,A、B、C、D、E、F分别是C、N、F、S、Cl、Ar元素,
A.元素的非金属性越强,其最高价氧化物的水化物酸性越强,但O、F元素除外;
B.离子电子层数越多其离子半径越大,电子层结构相同的离子,离子半径随着原子序数增大而减小;
C.稀有气体是单原子分子;
D.四氯化碳是常用的有机溶剂.
A.元素的非金属性越强,其最高价氧化物的水化物酸性越强,但O、F元素除外;
B.离子电子层数越多其离子半径越大,电子层结构相同的离子,离子半径随着原子序数增大而减小;
C.稀有气体是单原子分子;
D.四氯化碳是常用的有机溶剂.
解答:
解:根据元素在周期表中的位置知,A、B、C、D、E、F分别是C、N、F、S、Cl、Ar元素,
A.元素的非金属性越强,其最高价氧化物的水化物酸性越强,但O、F元素除外,非金属性E最强,所以最高价含氧酸酸性最强的是HClO4,故A错误;
B.离子电子层数越多其离子半径越大,电子层结构相同的离子,离子半径随着原子序数增大而减小,所以离子半径大小顺序是D>E>B>C,故B错误;
C.F是Ar元素,属于稀有气体,其分子是单原子分子,故C错误;
D.A是C、E是Cl元素,二者形成的化合物四氯化碳是常用的有机溶剂,故D正确;
故选D.
A.元素的非金属性越强,其最高价氧化物的水化物酸性越强,但O、F元素除外,非金属性E最强,所以最高价含氧酸酸性最强的是HClO4,故A错误;
B.离子电子层数越多其离子半径越大,电子层结构相同的离子,离子半径随着原子序数增大而减小,所以离子半径大小顺序是D>E>B>C,故B错误;
C.F是Ar元素,属于稀有气体,其分子是单原子分子,故C错误;
D.A是C、E是Cl元素,二者形成的化合物四氯化碳是常用的有机溶剂,故D正确;
故选D.
点评:本题考查元素周期表和元素周期律的综合应用,侧重考查知识运用能力,明确物质的构成、物质的性质、元素周期律即可解答,注意稀有气体属于单原子分子,为易错点.

练习册系列答案
相关题目
下列图中的实验方案,能达到实验目的是( )
| A | B | C | D | |
| 实验 方案 |  |  |  |  |
| 实验 目的 | 验证FeCl3对H2O2分解反应有催化作用 | 制备Fe(OH)2并能较长时间观察其颜色 | 除去CO2气体中混有的SO2 | 比较HCl、H2CO3和H2SiO3的酸性强弱 |
| A、A | B、B | C、C | D、D |
下列两种物质发生反应:①Na和O2 ②AlCl3与氨水 ③水玻璃与CO2 ④Fe与Cl2 ⑤Fe和稀HNO3,因反应物用量或反应条件的不同而生成不同产物的是( )
| A、①②③④⑤ | B、①②③⑤ |
| C、①②⑤ | D、①③⑤ |
关于溶液中微粒的浓度,下列说法正确的是( )
| A、0.1mol?L-1的(NH4)2SO4溶液中:c(SO42-)>c(NH4+)>c(H+)>c(OH-) | ||
| B、等浓度等体积的NaHSO3溶液与NaClO溶液混合后:c(Na+)+c(H+)=c(HSO3-)+c(ClO-)+2c(SO32-)+c(OH-) | ||
C、等浓度等体积的NaHCO3溶液与NaCl溶液混合后:
| ||
| D、标况下,将2.24L SO2气体通入到100ml 1mol?L-1的NaOH溶液中,完全反应后溶液呈酸性,则该溶液中:c(Na+)>c(HSO3-)>c(SO32-)>c(H+)>c(OH-) |
 向盛有氯气的集气瓶中,注入约五分之一的下列液体并轻轻振荡,观察到的现象记录如图所示,判断瓶中注入的液体是( )
向盛有氯气的集气瓶中,注入约五分之一的下列液体并轻轻振荡,观察到的现象记录如图所示,判断瓶中注入的液体是( )| A、AgNO3溶液 |
| B、NaOH溶液 |
| C、水 |
| D、FeCl2溶液 |
利用电解原理,在铁皮表面镀一层锌的有关叙述正确的是( )
| A、铁为负极,锌为正极 |
| B、铁为阳极,锌为阴极 |
| C、用可溶性铁盐作电解液 |
| D、锌元素既被氧化又被还原 |
下列关于化学平衡常数的说法中,正确的是( )
| A、在任何条件下,化学平衡常数K都是一个定值 |
| B、当改变反应物的浓度时,化学平衡常数会发生改变 |
| C、化学平衡常数K只与温度有关,与反应物浓度、体系的压强无关 |
| D、化学平衡常数K与反应物的转化率是一一对应的 |