题目内容
7.用化学知识回答下列问题:(1)CO2的摩尔质量为44g/mol;88g CO2的物质的量为2mol,所含二氧化碳分子数为2NA ,在标准状况下的体积约为44.8L.
(2)1.7g NH3共有1mol 质子;0.1mol CH4 共有NA个电子;同温同压下,同体积的NH3和CH4的质量比为17:16,同质量的NH3和CH4的体积比为16:17.
(3)已知1.2gRSO4中含0.01molR2+,则RSO4的摩尔质量是120g/mol;R的相对原子质量是24
分析 结合m=nM、V=nVm、N=nNA及分子构成计算.
解答 解:(1)CO2的摩尔质量为44g/mol;88g CO2的物质的量为$\frac{88g}{44g/mol}$=2mol,所含二氧化碳分子数为2NA个,在标准状况下的体积约为2mol×22.4L/mol=44.8L,
故答案为:44g/mol; 2mol;2 NA;44.8L;
(2)1.7g NH3共有$\frac{1.7g}{17g/mol}$×10=1mol 质子;0.1mol CH4 共有0.1mol×10×NA=NA个电子;同温同压下,同体积的NH3和CH4的物质的量相同,质量比为17:16,同质量的NH3和CH4的体积比为$\frac{m}{17}$:$\frac{m}{16}$=16:17,
故答案为:1;NA;17:16; 16:17;
(3)已知1.2gRSO4中含0.01molR2+,则RSO4的摩尔质量是$\frac{1.2g}{0.01mol}$=120g/mol;R的相对原子质量是120-96=24,故答案为:120g/mol;24.
点评 本题考查物质的量的计算,为高频考点,把握质量、体积、物质的量的关系为解答的关键,侧重分析与计算能力的考查,注意物质的构成及基本计算公式的应用,题目难度不大.

练习册系列答案
相关题目
18.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 标准状况下,22.4 L SO3含有NA个分子 | |
| B. | 过氧化钠与CO2反应时,0.1mol过氧化钠转移的电子数为0.2 NA | |
| C. | 6.4 g氧气和3.2 g臭氧(O3)混合气体所含有的氧原子数为0.6 NA | |
| D. | 标准状况下,2.24 L Cl2与过量的稀FeCl2溶液反应,转移电子总数为0.1 NA |
15.下列有关说法正确的是( )
| A. | 钢铁的电化学腐蚀和化学腐蚀往往同时发生 | |
| B. | 加入合适的催化剂,能降低反应活化能,从而改变反应的焓变 | |
| C. | 常温下,pH为5的氯化铵溶液和pH为9的醋酸钠溶液中水的电离程度不同 | |
| D. | 向BaSO4沉淀中加入饱和Na2CO3溶液后生成BaCO3,则Ksp(BaCO3)<Ksp(BaSO4) |
2.下列化学用语正确的是( )
①羟基的电子式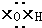 ②乙烯的结构简式:CH2=CH2
②乙烯的结构简式:CH2=CH2
③甲烷的结构式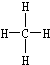 ④乙烯的结构式:C2H4
④乙烯的结构式:C2H4
⑤乙醛的结构简式 CH3COH ⑥硫化氢的电子式 H+[:S:]2-H+.
①羟基的电子式
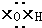 ②乙烯的结构简式:CH2=CH2
②乙烯的结构简式:CH2=CH2③甲烷的结构式
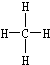 ④乙烯的结构式:C2H4
④乙烯的结构式:C2H4⑤乙醛的结构简式 CH3COH ⑥硫化氢的电子式 H+[:S:]2-H+.
| A. | ①④ | B. | ②④⑥ | C. | ②③ | D. | ②③⑤ |
12.X、Y、Z三种物质均含某种元素,箭头表示物质间的转化一步就能实现,则X不可能是( )


| A. | SiO2 | B. | CO2 | C. | Na | D. | HNO3 |
16.已知酸性条件下有如下反应:2Cu+═Cu2++Cu.由于反应温度不同,用氢气还原氧化铜时,可能产生Cu或Cu2O,两者都是红色固体.一同学对某次用氢气还原氧化铜实验所得的红色固体产物作了验证,实验操作和实验现象记录如下:
由此推出本次氢气还原氧化铜实验的产物是( )
| 加入试剂 | 稀硫酸 | 浓硫酸、加热 | 稀硝酸 | 浓硝酸 |
| 实验现象 | 红色固体和蓝色溶液 | 无色气体和蓝色溶液 | 无色气体和蓝色溶液 | 红棕色气体和蓝色溶液 |
| A. | Cu | B. | Cu2O | ||
| C. | 一定有Cu,可能有Cu2O | D. | 一定有Cu2O,可能有Cu |
17.下列有关有机物的叙述不正确的是( )
| A. | C4H8O2的酯有4种结构 | |
| B. | 淀粉和纤维素互为同分异构体 | |
| C. | 乙醇和葡萄糖均能发生酯化反应 | |
| D. | 用氢氧化钠溶液可以鉴别地沟油和矿物油 |
 近来,《饮用天然矿泉水》新标准引起热议,其中备受争议的溴酸盐是一种致癌物,新标准中溴酸盐限值为0.01mg/L.已知在酸性条件下有以下反应:
近来,《饮用天然矿泉水》新标准引起热议,其中备受争议的溴酸盐是一种致癌物,新标准中溴酸盐限值为0.01mg/L.已知在酸性条件下有以下反应: