题目内容
3. 近来,《饮用天然矿泉水》新标准引起热议,其中备受争议的溴酸盐是一种致癌物,新标准中溴酸盐限值为0.01mg/L.已知在酸性条件下有以下反应:
近来,《饮用天然矿泉水》新标准引起热议,其中备受争议的溴酸盐是一种致癌物,新标准中溴酸盐限值为0.01mg/L.已知在酸性条件下有以下反应:①2BrO3-+I2→2IO3-+Br2;
②2IO3-+10Br-+12H+→I2+5Br2+6H2O
③5Br-+BrO3-+6H+→3Br2+3H2O
请回答下列问题:
(1)有同学根据反应①得出氧化性:I2>Br2的结论,请说明该结论错误的理由该反应中I2作还原剂,Br2为还原产物,应得出还原性I2>Br2结论.
(2)反应②中:IO3-→I2发生的是还原反应(选填“氧化”、“还原”).
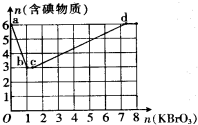
现向含6mol KI的硫酸溶液中逐滴加入KBrO3溶液,整个过程中含碘物质的物质的量与所加入KBrO3的物质的量有如图所示关系:
(3)a→b阶段的反应为(写出产物并配平)6I-+1BrO3-+6H+→Br-+3H2O+3I2.
(4)b→c阶段为反应③,其中氧化产物和还原产物的物质的量之比为5:1.
分析 (1)氧化还原反应中氧化剂的氧化性比氧化产物强;
(2)化合价降低的反应是还原反应;
(3)b点时,KI反应完全,有图象可知参加反应的KI为6mol,KBrO3为1mol,结合氧化剂、还原剂得失电子数目相等书写化学方程式;
(4)b→c过程中,仅有一种元素发生化合价变化,应是BrO3-与Br-之间的氧化还原反应.
解答 解:(1)反应2BrO3-+I2=2IO3-+Br2中,I2为还原剂,Br2为还原产物,应有还原性I2>Br2,该同学的结论不正确,
故答案为:该反应中I2作还原剂,Br2为还原产物,应得出还原性I2>Br2结论;
(2)反应②中:IO3-→I2过程中I元素化合价降低,发生的是还原反应,故答案为:还原;
(3)b点时,KI反应完全,有图象可知参加反应的KI为6mol,KBrO3为1mol,则消耗的氧化剂与还原剂物质的量之比为1;6,发生反应为6H++6I-+BrO3-=Br-+3H2O+3I2,故答案为:6 1 6 Br-+3H2O+3I2;
(4)b→c过程中,仅有一种元素发生化合价变化,应是BrO3-与Br-之间的氧化还原反应,反应的离子方程式为BrO3-+5Br-+6H+=3Br2+3H2O,其中氧化产物和还原产物的物质的量之比为5:1,
故答案为:5:1.
点评 本题考查氧化还原反应,题目难度较大,本题注意根据关系的关系式计算,为解答该题的关键,也是易错点.

练习册系列答案
相关题目
13.已知S2O8n-离子和H2O2一样含有过氧键,因此也有强氧化性,S2O8n-离子在一定条件下可把Mn2+氧化成MnO4-离子,若反应后S2O8n-离子变成SO42-;又知反应中氧化剂与还原剂的离子数之比为5:2,则S2O8n-中的n值和S的化合价是( )
| A. | 2,+7 | B. | 2,+6 | C. | 4,+7 | D. | 4,+6 |
18.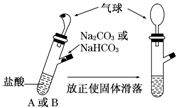 有A、B两个完全相同的装置,某学生分别在它们的侧管中装入1.06g Na2 CO3 和0.84g NaHCO3,A、B中分别有10mL相同浓度的盐酸,将两个侧管中的物质同时倒入各自的试管中下列叙述正确的是( )
有A、B两个完全相同的装置,某学生分别在它们的侧管中装入1.06g Na2 CO3 和0.84g NaHCO3,A、B中分别有10mL相同浓度的盐酸,将两个侧管中的物质同时倒入各自的试管中下列叙述正确的是( )
 有A、B两个完全相同的装置,某学生分别在它们的侧管中装入1.06g Na2 CO3 和0.84g NaHCO3,A、B中分别有10mL相同浓度的盐酸,将两个侧管中的物质同时倒入各自的试管中下列叙述正确的是( )
有A、B两个完全相同的装置,某学生分别在它们的侧管中装入1.06g Na2 CO3 和0.84g NaHCO3,A、B中分别有10mL相同浓度的盐酸,将两个侧管中的物质同时倒入各自的试管中下列叙述正确的是( )| A. | A装置的气球膨胀速率大 | |
| B. | 若最终两气球体积相同,则盐酸的浓度一定大于或等于2 mol/L | |
| C. | 若最终两气球体积不同,则盐酸的浓度一定小于或等于1 mol/L | |
| D. | 最终两试管中Na +、Cl - 的物质的量一定相同 |
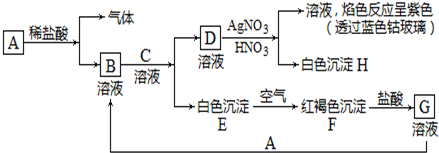

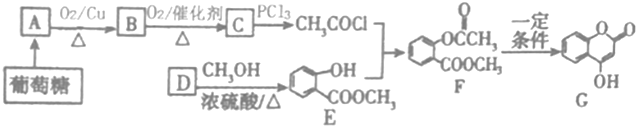
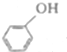 +NaOH→
+NaOH→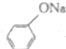 +H2O
+H2O .
.
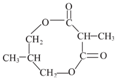 .
.