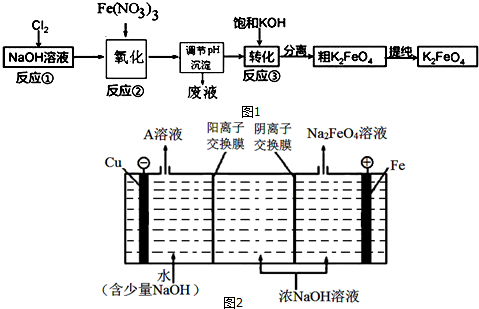
题目内容
9.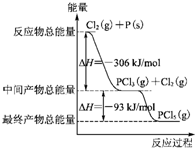 红磷P(s)和Cl2发生反应生成PCl3和PCl5,反应过程和能量关系如下图所示(图中的△H表示生成1mol产物的数据).根据图回答下列问题:
红磷P(s)和Cl2发生反应生成PCl3和PCl5,反应过程和能量关系如下图所示(图中的△H表示生成1mol产物的数据).根据图回答下列问题:(1)P和Cl2反应生成PCl3的热化学方程式:P(s)+$\frac{3}{2}$Cl2(g)═PCl3(g)△H=-306kJ•mol-1
(2)PCl5分解生成PCl3和Cl2的热化学方程式:PCl5(g)═PCl3(g)+Cl2(g)△H=+93kJ•mol-1
(3)工业上制备PCl5通常分两步进行,先将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5.原因是因为PCl5分解反应是吸热反应,温度太高,不利于PCl5的生成
(4)P和Cl2分两步反应生成1mol PCl5的△H3=-399kJ•mol-1
P和Cl2一步反应生成1mol PCl5的△H4等于△H3(填“大于”“小于”或“等于”).
(5)红磷和白磷互称为磷元素的同素异形体.
分析 (1)由图可知,生成1molPCl3放出的热量为306kJ,注明物质的聚集状态与反应热书写热化学方程式;
(2)由图象可知,1molPCl5分解成PCl3和Cl2需要吸收93kJ的能量,结合合化学方程式书写规则进行书写;
(3)PCl5分解反应是吸热反应,温度太高,不利于PCl5的生成;
(4)根据盖斯定律可知,反应无论一步完成还是分多步完成,生成相同的产物,反应热不变,即一步的反应热等于各步反应热之和;
(5)红磷和白磷为磷元素组成的结构不同的单质,互为同素异形体.
解答 解:(1)由图象可知,1molP与Cl2反应生成1molPCl3放出306kJ的能量,则反应的热化学方程式为P(s)+$\frac{3}{2}$Cl2(g)═PCl3(g)△H=-306kJ•mol-1,
故答案为:P(s)+$\frac{3}{2}$Cl2(g)═PCl3(g)△H=-306kJ•mol-1;
(2)由图象可知,1molPCl5分解成PCl3和Cl2需要吸收93kJ的能量,则反应的热化学方程式为PCl5(g)═PCl3(g)+Cl2(g)△H=+93kJ•mol-1,
故答案为:PCl5(g)═PCl3(g)+Cl2(g)△H=+93kJ•mol-1;
(3)因为PCl5分解反应是吸热反应,温度太高,不利于PCl5的生成,故先将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5,
故答案为:因为PCl5分解反应是吸热反应,温度太高,不利于PCl5的生成;
(4)由图象可知,P和Cl2分两步反应生成1molPCl5的△H3=-306kJ/mol-(+93kJ/mol)=-399kJ/mol,根据盖斯定律可知,反应无论一步完成还是分多步完成,生成相同的产物,反应热相等,则P和Cl2一步反应生成1molPCl5的反应热等于P和Cl2分两步反应生成1molPCl5的反应热.
故答案为:-399kJ•mol-1;等于;
(5)红磷和白磷为磷元素组成的结构不同的单质,互为同素异形体,
故答案为:同素异形体.
点评 本题考查热化学方程式的书写、盖斯定律的应用,题目难度不大,注意正确理解并运用盖斯定律,注意热化学方程式的书写方法.

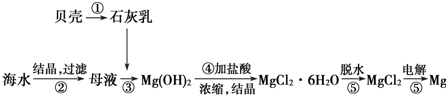
下列说法不正确的是( )
| A. | 用此法提取镁的优点之一是原料来源丰富 | |
| B. | 电解MgCl2时阳极产生镁 | |
| C. | 步骤⑤可将晶体置于HCl气体氛围中脱水制无水氯化镁 | |
| D. | 上述工艺流程中涉及到化合、分解和复分解反应 |
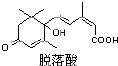 脱落酸是一种抑制生长的植物激素,因能促使叶子脱落而得名,其结构如图所示:则有关脱落酸的说法正确的是 ( )
脱落酸是一种抑制生长的植物激素,因能促使叶子脱落而得名,其结构如图所示:则有关脱落酸的说法正确的是 ( )| A. | 脱落酸的化学式C15H18O4 | |
| B. | 脱落酸只能和醇类发生酯化反应 | |
| C. | 1 mol 脱落酸最多可以和2 mol 金属钠发生反应 | |
| D. | 1 mol 脱落酸最多可以和2 mol 氢气发生加成反应 |
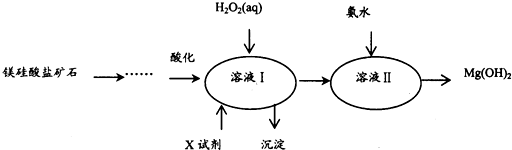
己知1:溶液I中除MgSO4外,还含有少量Fe3+、Al3+、Fe2+等离子
2:几种金属阳离子的氢氧化物沉淀时的pH如下表所示:
| Fe3+ | Al3+ | Fe2+ | Mg2+ | |
| 开始沉淀时 | 1.5 | 3.3 | 6.5 | 9.4 |
| 沉淀完全时 | 3.7 | 5.2 | 9.7 | 12.4 |
 .
.(2)向溶液I中加入X的作用是调节溶液pH.
(3)向溶液I中加入的两种试剂先后顺序是H2O2、MgO[Mg(OH)2或MgCO3](填化学式).
(4)加入H2O2溶液反应的离子方程式是2Fe2++H2O2+2H+=2Fe3++2H2O.
(5)如图是溶液Ⅱ中Mg2+转化率随温度t的变化示意图:
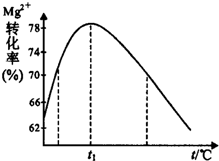
①向溶液Ⅱ中加入氨水反应的离子方程式是Mg2++2NH3•H2O=Mg(OH)2↓+2NH4+.
②t1前Mg2+转化率增大的原因是镁离子与氨水反应是吸热反应,升高温度,平衡右移,Mg2+转化率增大;t1后Mg2+转化率下降的原因是(用化学方程式表示)NH3•H2O$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O.
| 溶质 | NaF | NaClO | Na2CO3 |
| pH | 7.5 | 9.7 | 11.6 |
| A. | 根据上表,向足量NaClO溶液中通入CO2:CO2+H2O+2ClOˉ═2HClO+CO32- | |
| B. | 向上述 NaClO溶液中通HF气体至恰好完全反应时:c(Na+)>c(F-)>c(HClO) | |
| C. | 在相同温度下,同浓度的三种酸溶液的导电能力顺序:H2CO3<HClO<HF | |
| D. | 若将CO2通入0.1mol•L-1Na2CO3溶液中至溶液中性,则溶液中2c(CO32-)+c (HCO3-)=0.1 mol•L-1 |
| A. | 检验溴乙烷中的溴:取溴乙烷加氢氧化钠溶液,加热,再加硝酸银溶液有浅黄色沉淀生成 | |
| B. | 检验葡萄糖:在硝酸银溶液中滴加稀氨水至沉淀恰好溶解再加少许葡萄糖溶液,水浴加热 | |
| C. | 检验乙醛:加入2% 硫酸铜溶液2 mL再加入2% NaOH溶液2 mL;加热至沸腾 | |
| D. | 实验室制乙烯:取浓硫酸和乙醇体积比1:3的溶液加热到170℃ |