题目内容
14.从海水中提取镁的工艺流程图可表示如图: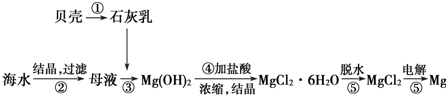
下列说法不正确的是( )
| A. | 用此法提取镁的优点之一是原料来源丰富 | |
| B. | 电解MgCl2时阳极产生镁 | |
| C. | 步骤⑤可将晶体置于HCl气体氛围中脱水制无水氯化镁 | |
| D. | 上述工艺流程中涉及到化合、分解和复分解反应 |
分析 从海水中提取镁的工艺流程:利用贝壳分解生成氧化钙,溶于水得到氢氧化钙加入到母液中沉淀镁离子,过滤得到氢氧化镁沉淀,加入盐酸溶解,通过浓缩蒸发冷却结晶方法得到氯化镁晶体,氯化氢气流中脱水得到氯化镁固体,电解熔融氯化镁制备镁.
A.从海水中制取镁,原料来源丰富;
B.根据电解时,阴极才是阳离子放电;
C.考虑镁离子的水解,一定条件是防止水解的发生;
D.根据从海水中提取镁的工艺流程分析各反应类型.
解答 解:从海水中提取镁的工艺流程:利用贝壳分解生成氧化钙CaCO3 $\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑,溶于水得到氢氧化钙CaO+H2O═Ca(OH)2,加入到母液中沉淀镁离子Mg2++2OH -=Mg(OH)2↓,过滤得到氢氧化镁沉淀,加入盐酸溶解,2HCl+Mg(OH)2═MgCl2+2H2O,通过浓缩蒸发冷却结晶方法得到氯化镁晶体,氯化氢气流中脱水得到氯化镁固体,电解熔融氯化镁制备镁MgCl2(熔融)$\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑.
A.海水中镁元素含量高,原料来源于海水,提取镁原料来源丰富,故A正确;
B.电解熔融MgCl2可得到金属镁,镁离子在阴极放电,电极反应方程式为:Mg2++2e-=Mg,故B错误;
C.MgCl2•6H2O在一定条件下加热得到无水MgCl2,若直接加热MgCl2•6H2O,会促进Mg2+水解,得不到无水MgCl2,因Mg2+水解呈酸性,在氯化氢气流中可抑制Mg2+水解,同时带走水蒸气,故一定条件为在HCl气流中,目的是抑制Mg2+水解,故C正确;
D.上述工艺流程中贝壳分解涉及分解反应,得到石灰乳涉及化合反应,③④为复分解反应,最后两个反应都是分解反应,故D正确;
故选:B.
点评 本题考查元素及其化合物,明确流程中发生的化学反应是解答的关键,注重基础知识和实验基本技能的训练,题目难度中等.

| A. | 按系统命名法,有机物(CH3)2CHCH(CH2CH3)(CH2CH2CH3)的命名为:2-甲基-3-丙基戊烷 | |
| B. | 已知C-C键可以绕键轴自由旋转,结构简式为 分子中至少有7个碳原子处于同一直线上 分子中至少有7个碳原子处于同一直线上 | |
| C. | 肌醇 与葡萄糖 与葡萄糖 的元素组成相同,化学式均为C6H12O6,满足Cm(H2O)n,因此,均属于糖类化合物 的元素组成相同,化学式均为C6H12O6,满足Cm(H2O)n,因此,均属于糖类化合物 | |
| D. |  与足量的NaOH溶液发生反应时,所得有机产物的化学式为C9H6O6Na4 与足量的NaOH溶液发生反应时,所得有机产物的化学式为C9H6O6Na4 |
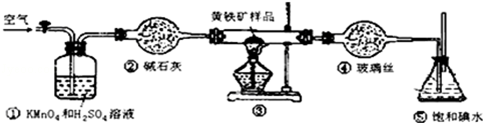
实验的正确操作步骤如下:
A.连接好装置,并检查装置的气密性
B.称取研细的黄铁矿样品
C.将2.0g样品小心地放入硬质玻璃管中
D.以1L/min的速率鼓入空气
E.将硬质玻璃管中的黄硫铁矿样品加热到800℃~850℃
F.用200mL的饱和碘水吸收SO2,发生的反应是:I2+SO2+2H2O═2HI+H2SO4
G.吸收液用CCl4萃取
H.取20.00mL吸收液,用标准0.2000mol•L-1的NaOH溶液滴定.
试回答:
(1)写出装置③中发生反应的化学方程式4FeS2+11O2$\frac{\underline{\;\;△\;\;}}{\;}$2Fe2O3+8SO2.
(2)步骤G中所用主要仪器是分液漏斗,应取上(填“上”或“下”)层溶液进行后续实验.
(3)装置①的作用是除去空气中的还原性气体,提高实验的准确率.
(4)步骤H中滴定时应选用酚酞作指示剂,可以根据滴入最后一滴NaOH溶液后,溶液变为浅红色,并在半分钟内不褪色现象来判断滴定已经达到终点.
(5)假定黄硫铁矿中的硫在操作E中已全部转化为SO2,并且被饱和碘水完全吸收.滴定得到的数据如表所示:
| 滴定次数 | 待测液体的体积/mL | 标准碱溶液的体积/mL | |
| 滴定前 | 滴定后 | ||
| 第一次 | 20.00mL | 0.00 | 20.98 |
| 第二次 | 20.00mL | 0.22 | 20.20 |
| 第三次 | 20.00mL | 0.36 | 20.38 |
(6)也有人提出用“沉淀质量法”测定黄铁矿中含硫质量分数,若用这种方法测定,最好是在装置⑤所得吸收液中加入下列哪种试剂D.
A.硝酸银溶液 B.氯化钙溶液 C.澄清石灰水 D.氯化钡溶液.
 在容积为2.0L的密闭容器内,物质D在T℃时发生反应,其反应物和生成物的物质的量随时间t的变化关系如图,下列叙述错误的是( )
在容积为2.0L的密闭容器内,物质D在T℃时发生反应,其反应物和生成物的物质的量随时间t的变化关系如图,下列叙述错误的是( )| A. | 从反应开始到第一次达到平衡时,A物质的平均反应速率为0.067mol/(L•min) | |
| B. | 根据如图该反应的平衡常数表达式为k=c2(A)•c(B) | |
| C. | 若在第5分钟时升高温度,则该反应的正反应是吸热反应,反应的平衡常数增大,B的反应速率增大 | |
| D. | 若在第7分钟时增加D的物质的量,A的物质的量变化情况符合a曲线 |
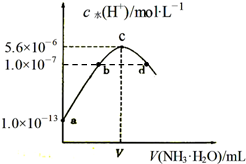 常温下,向20mL某浓度的硫酸溶液中滴入0.1mol•L-1氨水,溶液中水电离的氢离子浓度随加入氨水的体积变化如图.下列分析正确的是( )
常温下,向20mL某浓度的硫酸溶液中滴入0.1mol•L-1氨水,溶液中水电离的氢离子浓度随加入氨水的体积变化如图.下列分析正确的是( )| A. | 由图可知稀硫酸的浓度为0.1 mol•L-1 | |
| B. | b点溶液pH=7 | |
| C. | c点所示溶液中:c(SO42-)>c(NH4+)>c(H+)>c(OH-) | |
| D. | d点所示溶液中:c(NH4+)=2c(SO42-) |
| A. | 原子序数:X>Y>Z>W | |
| B. | 离子半径:W>X>Z | |
| C. | W分别与Y、Z形成的化合物中化学键类型不同 | |
| D. | 气态氢化物的稳定性:W<Y |
 硼和氮元素在化学中有很重要的地位,回答下列问题:
硼和氮元素在化学中有很重要的地位,回答下列问题: .预计于2017年发射的“嫦娥五号”探测器采用的长征5号运载火箭燃料为偏二甲肼[(CH3)2NNH2].(CH3)2NNH2中N原子的杂化方式为sp3.
.预计于2017年发射的“嫦娥五号”探测器采用的长征5号运载火箭燃料为偏二甲肼[(CH3)2NNH2].(CH3)2NNH2中N原子的杂化方式为sp3. ,.
,.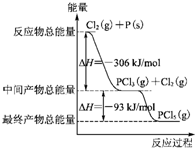 红磷P(s)和Cl2发生反应生成PCl3和PCl5,反应过程和能量关系如下图所示(图中的△H表示生成1mol产物的数据).根据图回答下列问题:
红磷P(s)和Cl2发生反应生成PCl3和PCl5,反应过程和能量关系如下图所示(图中的△H表示生成1mol产物的数据).根据图回答下列问题: