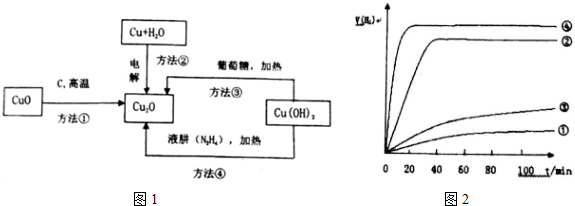
题目内容
4.高纯度的氢氧化镁广泛应用于医药、电力等领域.镁硅酸盐矿石可用于生产氢氧化镁,简要工艺流程如下: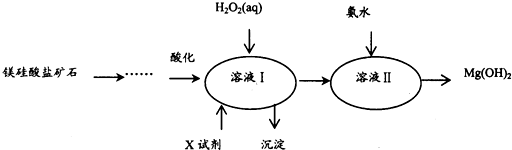
己知1:溶液I中除MgSO4外,还含有少量Fe3+、Al3+、Fe2+等离子
2:几种金属阳离子的氢氧化物沉淀时的pH如下表所示:
| Fe3+ | Al3+ | Fe2+ | Mg2+ | |
| 开始沉淀时 | 1.5 | 3.3 | 6.5 | 9.4 |
| 沉淀完全时 | 3.7 | 5.2 | 9.7 | 12.4 |
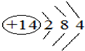 .
.(2)向溶液I中加入X的作用是调节溶液pH.
(3)向溶液I中加入的两种试剂先后顺序是H2O2、MgO[Mg(OH)2或MgCO3](填化学式).
(4)加入H2O2溶液反应的离子方程式是2Fe2++H2O2+2H+=2Fe3++2H2O.
(5)如图是溶液Ⅱ中Mg2+转化率随温度t的变化示意图:
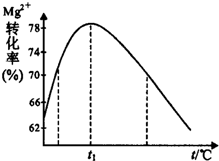
①向溶液Ⅱ中加入氨水反应的离子方程式是Mg2++2NH3•H2O=Mg(OH)2↓+2NH4+.
②t1前Mg2+转化率增大的原因是镁离子与氨水反应是吸热反应,升高温度,平衡右移,Mg2+转化率增大;t1后Mg2+转化率下降的原因是(用化学方程式表示)NH3•H2O$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O.
分析 溶液Ⅰ中除MgSO4外,还含有少量Fe3+、Al3+、Fe2+等离子,根据题中提供的各种金属离子沉淀的pH值可知,加入双氧水可以将亚铁离子氧化成铁离子,再加入试剂X主要作用是调节溶液pH值,使铁离子沉淀,可以加氧化镁或氢氧化镁等,过滤后在滤液中加入氨水使溶液中镁离子沉淀,得氢氧化镁沉淀,由于要通过使铁离子沉淀的方法除去铁,所以要先氧化再沉淀,根据Mg2+转化率随温度t的变化示意图可知,由于氨水与镁离子反应生成氢氧化镁的反应是吸热反应,所以升高温度,镁离子的转化率增大,但随着温度的升高,氨气在水中的溶解度减小,氨水的浓度减小,会导致Mg2+转化率减小,以此解答该题.
解答 解:溶液Ⅰ中除MgSO4外,还含有少量Fe3+、Al3+、Fe2+等离子,根据题中提供的各种金属离子沉淀的pH值可知,加入双氧水可以将亚铁离子氧化成铁离子,再加入试剂X主要作用是调节溶液pH值,使铁离子沉淀,可以加氧化镁或氢氧化镁等,过滤后在滤液中加入氨水使溶液中镁离子沉淀,得氢氧化镁沉淀,由于要通过使铁离子沉淀的方法除去铁,所以要先氧化再沉淀,根据Mg2+转化率随温度t的变化示意图可知,由于氨水与镁离子反应生成氢氧化镁的反应是吸热反应,所以升高温度,镁离子的转化率增大,但随着温度的升高,氨气在水中的溶解度减小,氨水的浓度减小,会导致Mg2+转化率减小,
(1)Mg的原子序数为12,原子核外有3个电子层,最外层电子数为2,则位于周期表第三周期ⅡA族,Si的原子核外有3个电子层,最外层电子数为4,原子结构示意图为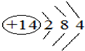 ,
,
故答案为:第三周期ⅡA族;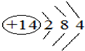 ;
;
(2)根据上面的分析可知,向溶液Ⅰ中加入X的作用是调节溶液pH,
故答案为:调节溶液pH;
(3)根据上面的分析可知,要先氧化再沉淀,所以向溶液Ⅰ中加入的两种试剂先后顺序是H2O2、MgO[Mg(OH)2或MgCO3],故答案为:H2O2、MgO[Mg(OH)2或MgCO3];
(4)根据上面的分析可知,加入H2O2溶液反应的离子方程式是2Fe2++H2O2+2H+=2Fe3++2H2O,
故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
(5)①向溶液Ⅱ中加入氨水与镁离子反应生成氢氧化镁沉淀,反应的离子方程式是 Mg2++2NH3•H2O=Mg(OH)2↓+2NH4+,
故答案为:Mg2++2NH3•H2O=Mg(OH)2↓+2NH4+;
②根据上面的分析可知,t1前Mg2+转化率增大的原因是 升高温度,Mg2+转化率增大,平衡右移,反应是吸热反应;t1后Mg2+转化率下降的原因是氨气在水中的溶解度减小,氨水的浓度减小,反应的方程式为 NH3•H2O $\frac{\underline{\;\;△\;\;}}{\;}$ NH3↑+H2O,
故答案为:镁离子与氨水反应是吸热反应,升高温度,平衡右移,Mg2+转化率增大;NH3•H2O$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O.
点评 本题考查物质制备方案,涉及物质分离提纯、离子沉淀的条件选择、化学平衡的影响因素、离子方程式的书写、沉淀转化的原理应用,侧重于学生的分析能力和实验能力的考查,难度中等.

 在容积为2.0L的密闭容器内,物质D在T℃时发生反应,其反应物和生成物的物质的量随时间t的变化关系如图,下列叙述错误的是( )
在容积为2.0L的密闭容器内,物质D在T℃时发生反应,其反应物和生成物的物质的量随时间t的变化关系如图,下列叙述错误的是( )| A. | 从反应开始到第一次达到平衡时,A物质的平均反应速率为0.067mol/(L•min) | |
| B. | 根据如图该反应的平衡常数表达式为k=c2(A)•c(B) | |
| C. | 若在第5分钟时升高温度,则该反应的正反应是吸热反应,反应的平衡常数增大,B的反应速率增大 | |
| D. | 若在第7分钟时增加D的物质的量,A的物质的量变化情况符合a曲线 |
| A. | 各元素在元素周期表中的族序数:W=X>Y>Z | |
| B. | 最高价氧化物对应的水化物的酸性:W>Z | |
| C. | 离子半径:X>Y>Z | |
| D. | YW3不能与NaOH溶液反应 |
| a | ||
| c |
| A. | b离子发生水解使溶液呈酸性,c离子发生水解使溶液呈碱性 | |
| B. | 原子半径由小到大的顺序为:d<c<b | |
| C. | a的气态氢化物是造成温室效应的气体之一 | |
| D. | c在氧气中燃烧生成的产物有两种 |
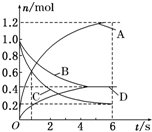 一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示(6s时反应已达到平衡状态),对该反应的推断正确的是( )
一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示(6s时反应已达到平衡状态),对该反应的推断正确的是( )| A. | 该反应的化学方程式为3B+4D?6A+2C | |
| B. | 反应进行到1s时,v(A)=v(C) | |
| C. | 反应进行到6s时,B和D的物质的量浓度均为0.4mol•L-1 | |
| D. | 反应进行到6s时,B的平均反应速率为0.05mol/(L•s) |
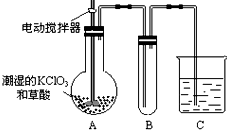 用二氧化氯(CLO2)、高铁酸钠 Na2FeO4摩尔质量为166g•mol-1等新型
用二氧化氯(CLO2)、高铁酸钠 Na2FeO4摩尔质量为166g•mol-1等新型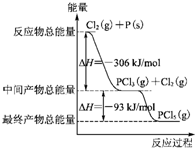 红磷P(s)和Cl2发生反应生成PCl3和PCl5,反应过程和能量关系如下图所示(图中的△H表示生成1mol产物的数据).根据图回答下列问题:
红磷P(s)和Cl2发生反应生成PCl3和PCl5,反应过程和能量关系如下图所示(图中的△H表示生成1mol产物的数据).根据图回答下列问题: