题目内容
16.运用化学反应原理研究NH3的性质具有重要意义.请回答下列问题:(1)氨气可以构成燃料电池,其电池反应原理为4NH3+3O2=2N2+6H2O.NH3应通入燃料电池的负极(填“正极”或“负极”).已知电解质溶液为KOH溶液,负极的电极反应式为2NH3+6OH--6e-═N2+6H2O.
(2)在0.5L恒容密闭容器中,一定量的N2与H2进行反应:N2(g)+3H2(g)?2NH3(g)△H=bkJ•mol-1,其化学平衡常数K与温度的关系如表:
| 温度/℃ | 200 | 300 | 400 |
| K | 1.0 | 0.85 | 0.5 |
②理论上,为了增大平衡时H2的转化率,可采取的措施是ad(填字母序号);
a.增大压强 b.使用合适的催化剂
c.升高温度 d.及时分离出产物中的NH3
③400℃时,测得某时刻氨气、氮气、氢气的物质的量分别为3mol、2mol、1mol时,此时刻该反应的v正(N2) 小于v逆(N2)(填“大于”“小于”或“等于”).
(3)已知:
①4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H=-1266.8kJ•mol-1
②N2(g)+O2(g)═2NO(g)△H=+180.5kJ•mol-1
写出氨高温催化氧化的热化学方程式4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=-905.8 kJ/mol.
分析 (1)氨气可以构成燃料电池,其电池反应原理为4NH3+3O2=2N2+6H2O.氨分子中氮元素的化合价升高,发生氧化反应,应通入燃料电池的负极;电解质溶液为KOH溶液,负极的电极反应式为2NH3+6OH--6e-═N2+6H2O;
(2)①化学平衡常数等于平衡时生成物的浓度幂之积比上反应物浓度幂之积;温度升高K减小,所以正反应是放热反应;
②a.增大压强,平衡正向移动,H2的转化率增大;
b.使用合适的催化剂,平衡不移动;
c.升高温度,平衡逆向移动,所以H2的转化率减小;
d.及时分离出产物中的NH3,平衡正向移动,H2的转化率增大;
③根据平衡常数和浓度商的相对大小分析解答;
(3)已知:①4NH3(g)+3O2(g)═2N2(g)+6H2O(g);△H=-1266.8kJ/mol;
②N2(g)+O2(g)═2NO(g);△H=+180.5kJ/mol,利用盖斯定律可求知反应热;
解答 解:(1)氨气可以构成燃料电池,其电池反应原理为4NH3+3O2=2N2+6H2O.氨分子中氮元素的化合价升高,发生氧化反应,应通入燃料电池的负极;电解质溶液为KOH溶液,负极的电极反应式为2NH3+6OH--6e-═N2+6H2O,故答案为:负极;2NH3+6OH--6e-═N2+6H2O;
(2)①化学平衡常数等于平衡时生成物的浓度幂之积比上反应物浓度幂之积,则K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})•{c}^{3}({H}_{2})}$;温度升高K减小,所以正反应是放热反应,所以b<0,故答案为:K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})•{c}^{3}({H}_{2})}$;小于;
②a.增大压强,平衡正向移动,H2的转化率增大,故符合;
b.使用合适的催化剂,平衡不移动,氢气的转化率不变,故不符合;
c.升高温度,平衡逆向移动,所以H2的转化率减小,故不符合;
d.及时分离出产物中的NH3,平衡正向移动,H2的转化率增大,故符合;
故选:ad;
③Qc=$\frac{(\frac{3}{0.5})^{2}}{\frac{2}{0.5}×(\frac{1}{0.5})^{3}}$=1.125>K,所以平衡逆向移动,则v正(N2)<v逆(N2),故答案为:小于;
(3)已知:①4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H=-1266.8kJ/mol,
②N2(g)+O2(g)═2NO(g)△H=+180.5kJ/mol,
利用盖斯定律①-2×②可得:4NH3(g)+5O2(g)=4NO(g)+6H2O(g);△H=-905.8KJ/mol,故答案为:4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=-905.8 kJ/mol.
点评 本题考查化学反应与能量、化学平衡移动等问题,题目难度中等,注意外界条件对化学平衡的影响,注意有关化学平衡的计算方法.

| A. | 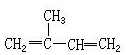 2-甲基-1,3-丁二烯 2-甲基-1,3-丁二烯 | B. | 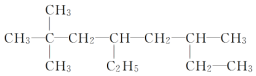 2,2-二甲基-4,6-二乙基庚烷 2,2-二甲基-4,6-二乙基庚烷 | ||
| C. |  1,3,4-三甲苯 1,3,4-三甲苯 | D. |  2-甲基-3-戊烯 2-甲基-3-戊烯 |
| A. | 1H、2H、3H、H+、H2是氢元素形成的五种不同粒子 | |
| B. | 16O与18O的性质完全不同 | |
| C. | 氯原子的结构示意图  | |
| D. | 碳酸钠的电离方程式:Na2CO3=Na++CO32- |
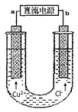
| A. | a端是直流电源的负极 | |
| B. | 通电使CuCl2发生电离 | |
| C. | 阴极上发生的反应:Cu2++2e-=Cu | |
| D. | 通电后,在阳极附近可观察到黄绿色气体 |
 实验室用氢氧化钠固体配制1.0mol•L-1的NaOH溶液250mL,回答下列问题:
实验室用氢氧化钠固体配制1.0mol•L-1的NaOH溶液250mL,回答下列问题: ;氮元素通常转化为化肥铵盐,铵根离子的电子式为
;氮元素通常转化为化肥铵盐,铵根离子的电子式为 .
. 2015年8月12日23:30左右,天津滨海新区的一处集装箱码头发生爆炸,发生爆炸的是集装箱内的易燃易爆物品氰化钠,数量为700吨左右.
2015年8月12日23:30左右,天津滨海新区的一处集装箱码头发生爆炸,发生爆炸的是集装箱内的易燃易爆物品氰化钠,数量为700吨左右.