题目内容
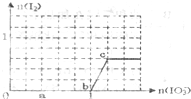 已知:还原性还原性HSO3->I-,氧化性IO3->I2.在含3mol NaHSO3的溶液中逐滴加入KIO3溶液.加入KIO3和析出I2的物质的量的关系曲线如图所示.下列说法正确的是( )
已知:还原性还原性HSO3->I-,氧化性IO3->I2.在含3mol NaHSO3的溶液中逐滴加入KIO3溶液.加入KIO3和析出I2的物质的量的关系曲线如图所示.下列说法正确的是( )| A、反应过程中的氧化产物均为SO3 |
| B、a点时剩余NaHSO3的物质的量为1.2 mol |
| C、b点时的还原产物可能是KI或NaI |
| D、当溶液中I-与I2的物质的量之比为1:1时,加入的KIO3为1.1mol |
考点:氧化还原反应的计算
专题:
分析:还原性HSO-3>I-,所以首先是发生以下反应离子方程式:IO3-+3HSO3-═I-+3SO42-+3H+,继续加入KIO3,氧化性IO-3>I2,所以IO3-可以结合H+氧化I-生成I2,离子方程式是IO3-+6H++5I-═3H2O+3I2,根据发生的反应来判断各个点的产物.
解答:
解:还原性HSO-3>I-,所以首先是发生以下反应离子方程式:IO3-+3HSO3-═I-+3SO42-+3H+,继续加入KIO3,氧化性IO-3>I2,所以IO3-可以结合H+氧化I-生成I2,离子方程式是IO3-+6H++5I-═3H2O+3I2,
A、0~b间没有碘单质生成,说明碘酸根离子和亚硫酸氢根离子发生氧化还原反应生成碘离子,加入碘酸钾的物质的量是1mol,亚硫酸氢钠的物质的量是3mol,亚硫酸氢根被氧化生成硫酸根离子,根据转移电子守恒知,生成碘离子,所以其离子方程式为:3HSO3-+IO3-═3SO42-+I-+3H+,氧化产物为SO42-;继续加入KIO3,氧化性IO-3>I2,所以IO3-可以结合H+氧化I-生成I2,离子方程式是IO3-+6H++5I-═3H2O+3I2,氧化产物为I2,故A错误;
B、a点碘酸钾的物质的量是0.4mol,根据碘酸钾和亚硫酸氢钠的关系式知,消耗NaHSO3的物质的量=
×3=1.2mol,则a点时剩余NaHSO3的物质的量为1.8 mol,故B错误;
C、根据图象知,b点碘酸根离子完全反应生成碘离子,所以其还原产物可能是碘化钠或碘化钾,故C正确;
D、根据反应2IO3-+6HSO3-═2I-+6SO42-+6H+,3mol NaHSO3的溶液消耗KIO3溶液的物质的量为1mol,生成碘离子的量为1mol,设生成的碘单质的物质的量为n,则根据反应IO3-+6H++5I-=3H2O+3I2,消耗的KIO3的物质的量为
mol,消耗碘离子的量为
mol,剩余的碘离子为(1-
)mol,当溶液中n(I-):n(I2)=1:1时,即(1-
)mol=nmol,故n=
mol,故加入的n(KIO3)=1mol+
mol=1mol+
mol=
mol,故D错误;
故选:C.
A、0~b间没有碘单质生成,说明碘酸根离子和亚硫酸氢根离子发生氧化还原反应生成碘离子,加入碘酸钾的物质的量是1mol,亚硫酸氢钠的物质的量是3mol,亚硫酸氢根被氧化生成硫酸根离子,根据转移电子守恒知,生成碘离子,所以其离子方程式为:3HSO3-+IO3-═3SO42-+I-+3H+,氧化产物为SO42-;继续加入KIO3,氧化性IO-3>I2,所以IO3-可以结合H+氧化I-生成I2,离子方程式是IO3-+6H++5I-═3H2O+3I2,氧化产物为I2,故A错误;
B、a点碘酸钾的物质的量是0.4mol,根据碘酸钾和亚硫酸氢钠的关系式知,消耗NaHSO3的物质的量=
| 0.4mol |
| 1 |
C、根据图象知,b点碘酸根离子完全反应生成碘离子,所以其还原产物可能是碘化钠或碘化钾,故C正确;
D、根据反应2IO3-+6HSO3-═2I-+6SO42-+6H+,3mol NaHSO3的溶液消耗KIO3溶液的物质的量为1mol,生成碘离子的量为1mol,设生成的碘单质的物质的量为n,则根据反应IO3-+6H++5I-=3H2O+3I2,消耗的KIO3的物质的量为
| n |
| 3 |
| 5n |
| 3 |
| 5n |
| 3 |
| 5n |
| 3 |
| 3 |
| 8 |
| n |
| 3 |
| 1 |
| 8 |
| 9 |
| 8 |
故选:C.
点评:本题考查了离子方程式的有关知识,明确氧化性、还原性前后顺序是解本题关键,结合方程式进行分析解答,易错点是D,根据物质间的反应并结合原子守恒计算,难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
工业上常用氯氧化法处理含氰(CN-)废水,一定条件下,氯气和CN-反应生成无毒气体.下列说法不正确的是( )
| A、CN-中碳元素的化合价为+2 |
| B、该反应的产物之一是无毒的N2 |
| C、当1 mol CN-参与反应时,转移3 mol e- |
| D、处理含0.1 mol CN-的废水,理论上需要消耗标准状况下Cl2的体积为5.6 L |
充分利用已有的数据是解决化学问题方法的重要途径.对数据的利用情况正确的是( )
| A、利用化学平衡常数判断化学反应进行的快慢 |
| B、利用溶解度数据判断氧化还原反应发生的可能性 |
| C、利用沸点数据推测将一些液体混合物分离的可能性 |
| D、利用物质的摩尔质量判断相同状态下不同物质密度的大小 |
糕点包装中常见的脱氧剂组成:还原性铁粉、氯化钠、炭粉等.脱氧过程中( )
| A、发生析氢腐蚀 |
| B、铁粉作阴极发生氧化反应 |
| C、含有1.12g铁粉的脱氧剂,理论上最多能吸收氧气336mL(标准状况) |
| D、可以吸热,从而降低温度,起保鲜糕点的作用 |
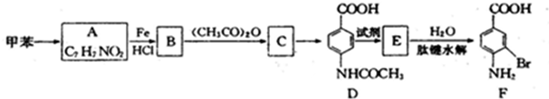
 ②苯环上有两个取代基,且处于对位
②苯环上有两个取代基,且处于对位


 CO中的C与O之间为叁键连接,则CO中碳氧叁键的键能是
CO中的C与O之间为叁键连接,则CO中碳氧叁键的键能是
 (其中-x、一y均为官能团).请回答下列问题:
(其中-x、一y均为官能团).请回答下列问题: