题目内容
12.下列说法正确的是( )| A. | 向25mL 沸水中滴加5-6 滴饱和FeCl3溶液(含0.1molFeCl3),得所胶体粒子小于NA | |
| B. | 丁达尔效应是胶体区别于溶液的本质特征 | |
| C. | 硅酸胶体可由饱和硅酸钠溶液中加入过量稀盐酸制得 | |
| D. | 氢氧化铁胶体电泳时阴极颜色加深,证明氢氧化铁胶体带正电 |
分析 A、一个氢氧化铁胶粒是多个氢氧化铁的聚集体;
B、溶液、胶体和浊液的本质区别是分散质粒子直径的大小;
C、向硅酸钠溶液中加入过量盐酸时,会使生成的胶体发生聚沉;
D、胶体不带电.
解答 解:A、一个氢氧化铁胶粒是多个氢氧化铁的聚集体,故0.1molFeCl3所形成的氢氧化铁胶粒个数小于0.1NA个,故A正确;
B、溶液、胶体和浊液的本质区别是分散质粒子直径的大小,而不是丁达尔效应,丁达尔效应只是胶体所特有的性质,故B错误;
C、向硅酸钠溶液中加入少量盐酸时,会生成硅酸胶体,当盐酸过量时,会使生成的胶体发生聚沉,得到硅酸沉淀,故C错误;
D、胶体不带电,故氢氧化铁胶体电泳时阴极颜色加深,只能说明氢氧化铁胶粒带电,故D错误.
故选A.
点评 本题考查了胶体的性质和三种分散系的本质区别,难度不大,应注意的是胶粒带电,但胶体不带电.

练习册系列答案
相关题目
3.下列说法正确的是( )
①非金属元素不可能组成离子化合物
②构成分子晶体的微粒一定含有共价键
③共价化合物中可能含有离子键
④离子化合物中可能含有共价键
⑤非极性键只存在于双原子单质分子里
⑥不同元素组成的多原子分子里的化学键一定都是极性键.
①非金属元素不可能组成离子化合物
②构成分子晶体的微粒一定含有共价键
③共价化合物中可能含有离子键
④离子化合物中可能含有共价键
⑤非极性键只存在于双原子单质分子里
⑥不同元素组成的多原子分子里的化学键一定都是极性键.
| A. | ①②④⑥ | B. | ②④⑤⑥ | C. | ①③⑤⑥ | D. | 只有④ |
20.下列说法正确的是( )
| A. | 非金属元素的原子间不能形成离子化合物 | |
| B. | 所有金属与所有非金属之间都能形成离子键 | |
| C. | 在化合物CaCl2中,两个氯离子之间也存在离子键 | |
| D. | 含有离子键的化合物一定是离子化合物 |
7.下列各组物质的晶体中,化学键类型相同、晶体类型也相同的是( )
| A. | SO2和SiO2 | B. | CO2和HClO | C. | NaCl和HCl | D. | CCl4和KCl |
17. 如图装置可用于收集气体X并验证其某些化学性质,你认为不正确的是( )
如图装置可用于收集气体X并验证其某些化学性质,你认为不正确的是( )
 如图装置可用于收集气体X并验证其某些化学性质,你认为不正确的是( )
如图装置可用于收集气体X并验证其某些化学性质,你认为不正确的是( )| 选项 | 气体 | 试剂 | 现象 | 结论 |
| ① | SO2 | 酸性高锰酸钾溶液 | 溶液褪色 | SO2有漂白性 |
| ② | NH3 | 滴有紫色石蕊的盐酸 | 溶液变蓝 | 氨水显碱性 |
| ③ | CO2 | 氯化钡溶液 | 溶液变浑浊 | 碳酸钡难溶于水 |
| ④ | Cl2 | 紫色石蕊试液 | 溶液先变红后褪色 | Cl2有酸性和漂白性 |
| A. | ③④ | B. | ②④ | C. | ①② | D. | 全部 |
4.从海带中提取碘要经过灼烧、浸取、过滤、氧化、萃取、分液、蒸馏等操作,下列对应的装置合理,操作规范的是( )
| A. |  海带灼烧成灰 | B. |  过滤含I-溶液 | C. |  放出碘的苯溶液 | D. |  分离碘并回收苯 |
2.H2、Cl2、O2组成混合气体,一定条件下恰好完全反应生成盐酸,则原混合气体中,H2、Cl2、O2的物质的量之比正确的是( )
| A. | 3:2:1 | B. | 6:1:2 | C. | 7:1:3 | D. | 7:4:1 |
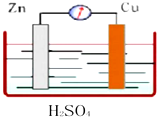 如图所示,Zn、Cu与稀硫酸形成的原电池装置中,负极材料为Zn,负极反应式为Zn-2e-=Zn2+;正极材料为Cu,正极反应式为2H++2e-=H2.
如图所示,Zn、Cu与稀硫酸形成的原电池装置中,负极材料为Zn,负极反应式为Zn-2e-=Zn2+;正极材料为Cu,正极反应式为2H++2e-=H2.