题目内容
1.某同学设计实验探究构成原电池的条件,装置如图(1、2):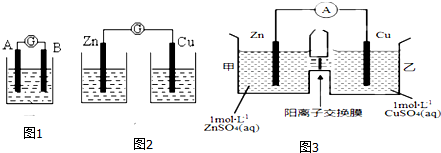
实验一:实验探究电极的构成(图1)
①A、B 两极均选用石墨作电极,发现电流计指针不偏转;
②A、B 两极均选用铜片作电极,发现电流计指针不偏转;
③A极用锌片,B极用铜片,发现电流计指针向左偏转;
④A极用锌片,B极用石墨,发现电流计指针向左偏转.
结论一:电极必须是两活泼性不同的电极.
实验二:探究溶液的构成(图2,A极用锌片,B极用铜片)
①液体采用无水乙醇,发现电流计指针不偏转;
②改用硫酸溶液,发现电流计指针偏转,B极上有气体产生.
结论二:溶液必须是电解质溶液.
实验三:对比实验,探究图3装置能否构成原电池
将锌、铜两电极分别放入稀硫酸溶液中,发现锌片上有气泡产生,铜片上无明显现象,电流计指针不发生偏转.
结论三:必须构成闭合回路.
思考:对该同学的实验,同学乙提出了如下疑问,请你帮助解决.
(1)在图1装置中,若A 为镁片,B为铝片,电解质溶液为NaOH溶液,电流计的指针应向左偏转.
此时负极电极反应式为:Al-3e-+4OH-=AlO2-+2H2O.
(2)如某装置如图3所示,其中阳离子交换膜只允许阳离子和水分子通过,此时电流表显示有电流通过,则下列有关叙述正确的是CD
A.铜上的电极反应Cu-2e-═Cu+
B.电池工作一段时间后,甲池的c(SO42-)减小
C.电池工作一段时间后,乙池溶液的总质量增加
D.锌电极发生氧化反应.
分析 实验一:由①②可知,当两极相同时,不能形成原电池;由③④可知,当两极是两种活泼性不同的金属或一种是金属一种是非金属时,可以形成原电池;
实验二:①中乙醇是非电解质,溶液中无自由移动离子;②中硫酸是电解质,硫酸溶液中有自由移动离子,能形成原电池;
实验三:要有电流,必须能形成闭合回路.
(1)在图1装置中,若A 为镁片,B为铝片,电解质溶液为NaOH溶液,铝与氢氧化钠溶液发生自发的氧化还原反应,所以铝是负极,镁是正极;此时负极电极反应式为:Al-3e-+4OH-=AlO2-+2H2O;
(2)由图象可知,该原电池反应式为:Zn+Cu2+=Zn2++Cu,Zn发生氧化反应,为负极,Cu电极上发生还原反应,为正极,阳离子交换膜只允许阳离子和水分子通过,两池溶液中硫酸根浓度不变,随反应进行,甲池中的Zn2+通过阳离子交换膜进入乙池,以保持溶液呈电中性,进入乙池的Zn2+与放电的Cu2+的物质的量相等,而Zn的摩尔质量大于Cu,故乙池溶液总质量增大.
解答 解:实验一:由①②可知,当两极相同时,不能形成原电池;由③④可知,当两极是两种活泼性不同的金属或一种是金属一种是非金属时,可以形成原电池;
故答案为:电极必须是两活泼性不同的电极;
实验二:①中乙醇是非电解质,溶液中无自由移动离子;②中硫酸是电解质,硫酸溶液中有自由移动离子,能形成原电池;故答案为:溶液必须是电解质溶液;
实验三:要有电流,必须能形成闭合回路.故答案为:必须构成闭合回路;
(1)在图1装置中,若A 为镁片,B为铝片,电解质溶液为NaOH溶液,铝与氢氧化钠溶液发生自发的氧化还原反应,所以铝是负极,镁是正极,电流计的指针应向左偏转,此时负极电极反应式为:Al-3e-+4OH-=AlO2-+2H2O,故答案为:左;Al-3e-+4OH-=AlO2-+2H2O;
(2)A.由图象可知,该原电池反应式为:Zn+Cu2+=Zn2++Cu,Zn为负极,发生氧化反应,Cu为正极,发生还原反应,故A错误;
B.阳离子交换膜只允许阳离子和水分子通过,故两池中c(SO42-)不变,故B错误;
C.甲池中的Zn2+通过阳离子交换膜进入乙池,乙池中发生反应:Cu2++2e-=Cu,保持溶液呈电中性,进入乙池的Zn2+与放电的Cu2+的物质的量相等,而Zn的摩尔质量大于Cu,故乙池溶液总质量增大,故C正确;
D.该原电池反应式为:Zn+Cu2+=Zn2++Cu,Zn为负极,发生氧化反应,故D正确,
故选:CD.
点评 本题考查了形成原电池的几个要件:活泼性不同的两个电极、电解质溶液和闭合回路,难度不大.

| A. | 向25mL 沸水中滴加5-6 滴饱和FeCl3溶液(含0.1molFeCl3),得所胶体粒子小于NA | |
| B. | 丁达尔效应是胶体区别于溶液的本质特征 | |
| C. | 硅酸胶体可由饱和硅酸钠溶液中加入过量稀盐酸制得 | |
| D. | 氢氧化铁胶体电泳时阴极颜色加深,证明氢氧化铁胶体带正电 |
| A. | 16g 甲烷中含有的原子数为NA | |
| B. | 标准状况下,2.24 LCCl4含有的共价键数为0.4NA | |
| C. | 4.6 g乙醇中含有的C-H键的个数为0.6NA | |
| D. | 14 g乙烯和丙烯(它是乙烯的同系物,相对分子质量相差14)混合气体中的氢原子数为2NA |
| A. | SO2具有氧化性,可用于漂白纸浆 | |
| B. | NaHCO3受热易分解,可通过加热方法除去碳酸钠中的碳酸氢钠杂质 | |
| C. | Na2O2能与水或二氧化碳反应产生氧气,可用作宇航员的供氧剂 | |
| D. | Al2O3熔点高,可用作耐高温材料 |
| A. | 新方法利用的是化学变化,旧方法利用的是物理变化 | |
| B. | 反应②中既有旧化学键的断裂又有新化学键的形成 | |
| C. | 在反应①中每生成 12g 金刚石需要消耗 46g 金属钠 | |
| D. | 反应①和反应②中所得的金刚石都是还原产物 |
试剂:a.水 b.NaOH溶液 c.溴水 d.饱和Na2CO3溶液 e.新制CaO f.饱和NaCl溶液
分离方法:A.分液 B.过滤 C.洗气 D.蒸馏 F.盐析
| 混合物 | 需加入的试剂 | 分离方法 |
| 苯(苯酚) | b | A |
| 乙烷(乙烯) | c | C |
| 乙醇(水) | e | D |
| 乙酸乙酯(乙酸) | d | A |
| A. | Na2CO3═2Na++CO32- | B. | AlCl3═Al3++3Cl- | ||
| C. | Mg(NO3)2═Mg+2+2NO3- | D. | KMnO4═K++Mn7++4O2- |
 研究CO、CO2的应用具有重要的意义.
研究CO、CO2的应用具有重要的意义.(1)CO可用于炼铁,已知:
Fe2O3(s)+3C(s)═2Fe(s)+3CO(g)△H1=+489.0kJ•mol-1
C(s)+CO2(g)═2CO(g)△H2=+172.5kJ•mol-1
则CO还原Fe2O3(s)的热化学方程式为Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5kJ•mol-1.
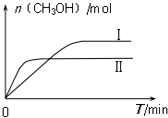
(2)CO2和H2充入一定体积的密闭容器中,在两种温度下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g);
测得CH3OH的物质的量随时间的变化图:
①由如图判断该反应△H< 0,曲线 I、II对应的平衡常数KI>KII
(填“>”或“=”或“<”).
②一定温度下,在容积相同且固定的两个密闭容器中,按如表方式加入反应物,一段时间后达到平衡.
| 容 器 | 甲 | 乙 |
| 反应物投入量 | 1molCO2、3molH2 | a molCO2、b molH2、 c molCH3OH(g)、c molH2O(g) |
③一定温度下,此反应在恒容密闭容器中进行,能判断该反应达到化学平衡状态的依据是ab.
a.容器中压强不变 b.H2的体积分数不变
c.c(H2)=3c(CH3OH) d.容器中密度不变
e.2个C=O断裂的同时有3个C-H形成
(2)将燃煤废气中的CO转化为二甲醚的反应原理为:2CO(g)+4H2(g)?CH3OCH3(g)+H2O(g).二甲醚与空气可设计成燃料电池,若电解质为碱性.写出该燃料电池的负极反应式CH3OCH3-12e-+16OH-═2CO32-+11H2O.根据化学反应原理,分析增加压强对制备二甲醚反应的影响该反应分子数减少,压强增加使平衡右移,CH3OCH3产率增加;压强增加使CO和H2浓度增加,反应速率增大.
 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的量随时间变化的曲线如图所示:从反应开始到10s,X的物质的量减少了0.8 mol,Z的物质的量浓度增大了0.8 mol/L,用Z表示的反应速率为0.08 mol/(L•s).
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的量随时间变化的曲线如图所示:从反应开始到10s,X的物质的量减少了0.8 mol,Z的物质的量浓度增大了0.8 mol/L,用Z表示的反应速率为0.08 mol/(L•s).