题目内容
2.H2、Cl2、O2组成混合气体,一定条件下恰好完全反应生成盐酸,则原混合气体中,H2、Cl2、O2的物质的量之比正确的是( )| A. | 3:2:1 | B. | 6:1:2 | C. | 7:1:3 | D. | 7:4:1 |
分析 发生反应为:2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O、H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl,一定条件下恰好完全反应生成盐酸,说明这三种气体没有剩余,则氢气的体积为氧气体积2倍与氯气之和,以此来解答.
解答 解:物质间的反应分别为:2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O、H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl,一定条件下恰好完全反应生成盐酸,说明这三种气体都没有剩余,
设氢气的物质的量xmol,氯气的物质的量ymol,氧气的物质的量zmol,氢气和氯气反应后,剩下氢气(x-y)和氧气(z)恰好反应的比例为2:1,(x-y):z=2:1,
A.如果H2、Cl2、O2的体积比为3:2:1,则(x-y):z=(3-2):1=1:1,不符合,故A错误;
B.如果H2、Cl2、O2的体积比为6:1:2,则(x-y):z=(6-1):2=5:2,不符合,故B错误;
C.如果H2、Cl2、O2的体积比为7:1:3,则(x-y):z=(7-1):3=2:1,符合条件,故C正确;
D.如果H2、Cl2、O2的体积比为7:4:1,则(x-y):z=(7-4):1=3:1,不符合,故D错误;
故选C.
点评 本题考查化学方程式的有关计算,明确物质间反应的关系式是解本题关键,注意题干中“恰好完全反应生成盐酸”的含义,再结合物质之间的物理量解答,题目难度中等.

练习册系列答案
 天天向上口算本系列答案
天天向上口算本系列答案
相关题目
12.下列说法正确的是( )
| A. | 向25mL 沸水中滴加5-6 滴饱和FeCl3溶液(含0.1molFeCl3),得所胶体粒子小于NA | |
| B. | 丁达尔效应是胶体区别于溶液的本质特征 | |
| C. | 硅酸胶体可由饱和硅酸钠溶液中加入过量稀盐酸制得 | |
| D. | 氢氧化铁胶体电泳时阴极颜色加深,证明氢氧化铁胶体带正电 |
13.请选用适当的试剂和分离方法除去下列物质中所含的杂质(括号内为杂质),将所选的试剂及方法的编号填入表中.
试剂:a.水 b.NaOH溶液 c.溴水 d.饱和Na2CO3溶液 e.新制CaO f.饱和NaCl溶液
分离方法:A.分液 B.过滤 C.洗气 D.蒸馏 F.盐析
试剂:a.水 b.NaOH溶液 c.溴水 d.饱和Na2CO3溶液 e.新制CaO f.饱和NaCl溶液
分离方法:A.分液 B.过滤 C.洗气 D.蒸馏 F.盐析
| 混合物 | 需加入的试剂 | 分离方法 |
| 苯(苯酚) | b | A |
| 乙烷(乙烯) | c | C |
| 乙醇(水) | e | D |
| 乙酸乙酯(乙酸) | d | A |
10.下列有关物质在水溶液中的电离方程式书写正确的是( )
| A. | Na2CO3═2Na++CO32- | B. | AlCl3═Al3++3Cl- | ||
| C. | Mg(NO3)2═Mg+2+2NO3- | D. | KMnO4═K++Mn7++4O2- |
1.下列物质中,在一定条件下能水解的高分子化合物是( )
| A. | 肥皂 | B. | 油脂 | C. | 纤维素 | D. | 氨基酸 |
8.下列高分子化合物的认识不正确的是( )
| A. | 有机高分子化合物被称为聚合物或高聚物,是因为它们大部分是由小分子通过聚合反应而得到的 | |
| B. | 有机高分子化合物的相对分子质量很大,因而其结构很复杂 | |
| C. | 对于一块高分子材料来说,n是一个整数值,因而它的相对分子质量是确定的. | |
| D. | 材料可分为天然高分子材料和合成高分子材料两大类 |
5. 研究CO、CO2的应用具有重要的意义.
研究CO、CO2的应用具有重要的意义.
(1)CO可用于炼铁,已知:
Fe2O3(s)+3C(s)═2Fe(s)+3CO(g)△H1=+489.0kJ•mol-1
C(s)+CO2(g)═2CO(g)△H2=+172.5kJ•mol-1
则CO还原Fe2O3(s)的热化学方程式为Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5kJ•mol-1.
(2)CO2和H2充入一定体积的密闭容器中,在两种温度下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g);
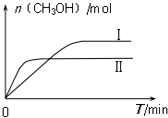
测得CH3OH的物质的量随时间的变化图:
①由如图判断该反应△H< 0,曲线 I、II对应的平衡常数KI>KII
(填“>”或“=”或“<”).
②一定温度下,在容积相同且固定的两个密闭容器中,按如表方式加入反应物,一段时间后达到平衡.
若甲中平衡后气体的压强为开始的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则c的取值范围为0.4<c≤1.
③一定温度下,此反应在恒容密闭容器中进行,能判断该反应达到化学平衡状态的依据是ab.
a.容器中压强不变 b.H2的体积分数不变
c.c(H2)=3c(CH3OH) d.容器中密度不变
e.2个C=O断裂的同时有3个C-H形成
(2)将燃煤废气中的CO转化为二甲醚的反应原理为:2CO(g)+4H2(g)?CH3OCH3(g)+H2O(g).二甲醚与空气可设计成燃料电池,若电解质为碱性.写出该燃料电池的负极反应式CH3OCH3-12e-+16OH-═2CO32-+11H2O.根据化学反应原理,分析增加压强对制备二甲醚反应的影响该反应分子数减少,压强增加使平衡右移,CH3OCH3产率增加;压强增加使CO和H2浓度增加,反应速率增大.
 研究CO、CO2的应用具有重要的意义.
研究CO、CO2的应用具有重要的意义.(1)CO可用于炼铁,已知:
Fe2O3(s)+3C(s)═2Fe(s)+3CO(g)△H1=+489.0kJ•mol-1
C(s)+CO2(g)═2CO(g)△H2=+172.5kJ•mol-1
则CO还原Fe2O3(s)的热化学方程式为Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5kJ•mol-1.
(2)CO2和H2充入一定体积的密闭容器中,在两种温度下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g);
测得CH3OH的物质的量随时间的变化图:
①由如图判断该反应△H< 0,曲线 I、II对应的平衡常数KI>KII
(填“>”或“=”或“<”).
②一定温度下,在容积相同且固定的两个密闭容器中,按如表方式加入反应物,一段时间后达到平衡.
| 容 器 | 甲 | 乙 |
| 反应物投入量 | 1molCO2、3molH2 | a molCO2、b molH2、 c molCH3OH(g)、c molH2O(g) |
③一定温度下,此反应在恒容密闭容器中进行,能判断该反应达到化学平衡状态的依据是ab.
a.容器中压强不变 b.H2的体积分数不变
c.c(H2)=3c(CH3OH) d.容器中密度不变
e.2个C=O断裂的同时有3个C-H形成
(2)将燃煤废气中的CO转化为二甲醚的反应原理为:2CO(g)+4H2(g)?CH3OCH3(g)+H2O(g).二甲醚与空气可设计成燃料电池,若电解质为碱性.写出该燃料电池的负极反应式CH3OCH3-12e-+16OH-═2CO32-+11H2O.根据化学反应原理,分析增加压强对制备二甲醚反应的影响该反应分子数减少,压强增加使平衡右移,CH3OCH3产率增加;压强增加使CO和H2浓度增加,反应速率增大.
6.既能与稀硫酸反应,又能与NaOH溶液反应,且都有气体放出的是( )
| A. | NaHCO3 | B. | Al(OH)3 | C. | (NH4)2CO3 | D. | Al2O3 |