题目内容
3.下列说法正确的是( )①非金属元素不可能组成离子化合物
②构成分子晶体的微粒一定含有共价键
③共价化合物中可能含有离子键
④离子化合物中可能含有共价键
⑤非极性键只存在于双原子单质分子里
⑥不同元素组成的多原子分子里的化学键一定都是极性键.
| A. | ①②④⑥ | B. | ②④⑤⑥ | C. | ①③⑤⑥ | D. | 只有④ |
分析 ①氯化铵是非金属元素形成的离子化合物;
②稀有气体中不存在任何化学键;
③只含共价键的化合物叫共价化合物;
④离子化合物氢氧化钠中,含有共价键;
⑤过氧化钠中存在氧氧非极性键;
⑥不同元素组成的多原子分子里可存在极性键、非极性键.
解答 解:①氯化铵是非金属元素形成的离子化合物,故错误;
②分子晶体稀有气体中不存在任何化学键,故错误;
③只含共价键的化合物叫共价化合物,所以不可能存在离子键,故错误;
④离子化合物氢氧化钠中,含有共价键,故正确;
⑤过氧化钠中存在氧氧非极性键,所以不一定只存在于双原子单质分子里,故错误;
⑥不同元素组成的多原子分子里可存在极性键、非极性键,如H-O-O-H中含非极性键,故错误;
故选D.
点评 本题考查化学键,为高频考点,把握离子键、共价键的形成及化学键的判断为解答的关键,侧重分析与应用能力的考查,注意利用实例分析,题目难度不大.

练习册系列答案
相关题目
13.某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
【实验原理】2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O
【实验内容及记录】
(1)请完成此实验设计,其中:V1=2.0,V2=3.0.
(2)实验①、②探究的是浓度对化学反应速率的影响,根据表中的实验数据,可以得到的结论是其他条件不变时,增大(减小)反应物浓度,加快(减慢)化学反应速率.
(3)探究温度对化学反应速率的影响,应选择②③(填实验编号).
(4)利用实验1中的数据,计算用KMnO4表示的化学反应速率为1.0×10-2mol/(L•min).
(5)该小组同学根据经验绘制了n(Mn2+)随时间变化的趋势如图1所示,但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的实际趋势如图2所示.
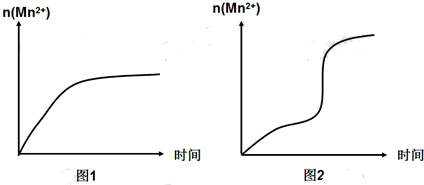
该小组同学根据图2所示信息提出了新的假设,并设计以下实验方案继续进行实验探究.
①该小组同学提出的假设是Mn2+对该反应有催化作用.
②若该小组同学提出的假设成立,应观察到加入MnSO4固体后,KMnO4溶液比实验②更快褪色现象.
【实验原理】2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O
【实验内容及记录】
| 实验编号 | 实验温度 | 试管中所加试剂及其用量/mL | 溶液褪至无色所需时间/min | |||
| 0.6mol/L H2C2O4溶液 | H2O | 3mol/L 稀H2SO4溶液 | 0.05mol/L KMnO4溶液 | |||
| ① | 25 | 3.0 | V1 | 2.0 | 3.0 | 1.5 |
| ② | 25 | 2.0 | 3.0 | 2.0 | 3.0 | 2.7 |
| ③ | 50 | 2.0 | V2 | 2.0 | 3.0 | 1.0 |
(2)实验①、②探究的是浓度对化学反应速率的影响,根据表中的实验数据,可以得到的结论是其他条件不变时,增大(减小)反应物浓度,加快(减慢)化学反应速率.
(3)探究温度对化学反应速率的影响,应选择②③(填实验编号).
(4)利用实验1中的数据,计算用KMnO4表示的化学反应速率为1.0×10-2mol/(L•min).
(5)该小组同学根据经验绘制了n(Mn2+)随时间变化的趋势如图1所示,但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的实际趋势如图2所示.

该小组同学根据图2所示信息提出了新的假设,并设计以下实验方案继续进行实验探究.
| 实验编号 | 实验温度/℃ | 试管中所加试剂及其用量 | 再向试管中加 入某种固体 | 溶液褪至无色所需时间/min | |||
| 0.6mol/L H2C 2O4溶液 | H2O | 3mol/L 稀H2SO4溶液 | 0.05mol/L KMnO4溶液 | ||||
| ④ | 25 | 2.0 | 3.0 | 2.0 | 3.0 | MnSO4 | t |
②若该小组同学提出的假设成立,应观察到加入MnSO4固体后,KMnO4溶液比实验②更快褪色现象.
14.如图是周期表中短周期的一部分,A、B、C三种元素的原子核外电子数之和等于B原子的质量数,B原子的原子核内质子数等于中子数.下列叙述正确的是( )
| A | C | |
| B |
| A. | 最高价氧化物对应水化物的酸性:C>B | |
| B. | C单质是氧化性最强的非金属单质 | |
| C. | A的氢化物中不可能含有非极性共价键 | |
| D. | B位于第三周期ⅦA族 |
18.表为六种短周期元素的部分性质,下列有关说法错误的是( )
| 元素代号 | X | Y | Z | Q | R | T |
| 原子半径/10-10m | 0.77 | 0.66 | 0.70 | 1.17 | 0.99 | 1.10 |
| 主要化合价 | +4、-4 | -2 | +5、-3 | +4、-4 | +7、-1 | +5、-3 |
| A. | X与Y可以形成阴离子XY32- | |
| B. | Z的氢化物的沸点比T的氢化物的沸点高 | |
| C. | 元素R的氧化物对应水化物一定为强酸 | |
| D. | 由X形成的化合物QX和XR4,其晶体类型不相同 |
8.下列变化中,吸收的能量用于克服分子间作用力的是( )
| A. | 加热氢氧化钠晶体使之熔化 | B. | 电解水使之分解 | ||
| C. | 碘单质受热升华 | D. | 加热二氧化硅晶体使之熔化 |
15.现有葡萄糖、丁醛、乙烯的混合物,若其中氧的质量分数为a,则碳的质量分数是( )
| A. | $\frac{6}{7}$(1-a) | B. | $\frac{3}{4}$a | C. | $\frac{1-a}{7}$ | D. | $\frac{12}{13}$(1-a) |
12.下列说法正确的是( )
| A. | 向25mL 沸水中滴加5-6 滴饱和FeCl3溶液(含0.1molFeCl3),得所胶体粒子小于NA | |
| B. | 丁达尔效应是胶体区别于溶液的本质特征 | |
| C. | 硅酸胶体可由饱和硅酸钠溶液中加入过量稀盐酸制得 | |
| D. | 氢氧化铁胶体电泳时阴极颜色加深,证明氢氧化铁胶体带正电 |
13.请选用适当的试剂和分离方法除去下列物质中所含的杂质(括号内为杂质),将所选的试剂及方法的编号填入表中.
试剂:a.水 b.NaOH溶液 c.溴水 d.饱和Na2CO3溶液 e.新制CaO f.饱和NaCl溶液
分离方法:A.分液 B.过滤 C.洗气 D.蒸馏 F.盐析
试剂:a.水 b.NaOH溶液 c.溴水 d.饱和Na2CO3溶液 e.新制CaO f.饱和NaCl溶液
分离方法:A.分液 B.过滤 C.洗气 D.蒸馏 F.盐析
| 混合物 | 需加入的试剂 | 分离方法 |
| 苯(苯酚) | b | A |
| 乙烷(乙烯) | c | C |
| 乙醇(水) | e | D |
| 乙酸乙酯(乙酸) | d | A |
 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的量随时间变化的曲线如图所示:从反应开始到10s,X的物质的量减少了0.8 mol,Z的物质的量浓度增大了0.8 mol/L,用Z表示的反应速率为0.08 mol/(L•s).
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的量随时间变化的曲线如图所示:从反应开始到10s,X的物质的量减少了0.8 mol,Z的物质的量浓度增大了0.8 mol/L,用Z表示的反应速率为0.08 mol/(L•s).