题目内容
2.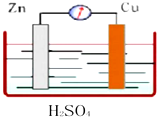 如图所示,Zn、Cu与稀硫酸形成的原电池装置中,负极材料为Zn,负极反应式为Zn-2e-=Zn2+;正极材料为Cu,正极反应式为2H++2e-=H2.
如图所示,Zn、Cu与稀硫酸形成的原电池装置中,负极材料为Zn,负极反应式为Zn-2e-=Zn2+;正极材料为Cu,正极反应式为2H++2e-=H2.
分析 该装置是原电池,Zn易失电子作负极、Cu作正极,负极反应式为Zn-2e-═Zn2+、正极反应式为2H++2e-=H2↑,据此分析解答.
解答 解:该装置能自发进行氧化还原反应,所以构成原电池,Zn易失电子发生氧化反应而作负极、Cu作正极,负极上电极反应式为Zn-2e-═Zn2+,铜是正极电极反应式为:2H++2e-=H2↑;故答案为:Zn,Zn-2e-=Zn2+;Cu,2H++2e-=H2.
点评 本题考查了原电池原理,明确正负极的判断方法、电极反应式的书写即可解答,题目难度不大.

练习册系列答案
相关题目
13.某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
【实验原理】2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O
【实验内容及记录】
(1)请完成此实验设计,其中:V1=2.0,V2=3.0.
(2)实验①、②探究的是浓度对化学反应速率的影响,根据表中的实验数据,可以得到的结论是其他条件不变时,增大(减小)反应物浓度,加快(减慢)化学反应速率.
(3)探究温度对化学反应速率的影响,应选择②③(填实验编号).
(4)利用实验1中的数据,计算用KMnO4表示的化学反应速率为1.0×10-2mol/(L•min).
(5)该小组同学根据经验绘制了n(Mn2+)随时间变化的趋势如图1所示,但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的实际趋势如图2所示.

该小组同学根据图2所示信息提出了新的假设,并设计以下实验方案继续进行实验探究.
①该小组同学提出的假设是Mn2+对该反应有催化作用.
②若该小组同学提出的假设成立,应观察到加入MnSO4固体后,KMnO4溶液比实验②更快褪色现象.
【实验原理】2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O
【实验内容及记录】
| 实验编号 | 实验温度 | 试管中所加试剂及其用量/mL | 溶液褪至无色所需时间/min | |||
| 0.6mol/L H2C2O4溶液 | H2O | 3mol/L 稀H2SO4溶液 | 0.05mol/L KMnO4溶液 | |||
| ① | 25 | 3.0 | V1 | 2.0 | 3.0 | 1.5 |
| ② | 25 | 2.0 | 3.0 | 2.0 | 3.0 | 2.7 |
| ③ | 50 | 2.0 | V2 | 2.0 | 3.0 | 1.0 |
(2)实验①、②探究的是浓度对化学反应速率的影响,根据表中的实验数据,可以得到的结论是其他条件不变时,增大(减小)反应物浓度,加快(减慢)化学反应速率.
(3)探究温度对化学反应速率的影响,应选择②③(填实验编号).
(4)利用实验1中的数据,计算用KMnO4表示的化学反应速率为1.0×10-2mol/(L•min).
(5)该小组同学根据经验绘制了n(Mn2+)随时间变化的趋势如图1所示,但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的实际趋势如图2所示.

该小组同学根据图2所示信息提出了新的假设,并设计以下实验方案继续进行实验探究.
| 实验编号 | 实验温度/℃ | 试管中所加试剂及其用量 | 再向试管中加 入某种固体 | 溶液褪至无色所需时间/min | |||
| 0.6mol/L H2C 2O4溶液 | H2O | 3mol/L 稀H2SO4溶液 | 0.05mol/L KMnO4溶液 | ||||
| ④ | 25 | 2.0 | 3.0 | 2.0 | 3.0 | MnSO4 | t |
②若该小组同学提出的假设成立,应观察到加入MnSO4固体后,KMnO4溶液比实验②更快褪色现象.
10.目前,科学界拟合成一种“双重结构”的球形分子,即把足球烯C60的分子容纳在Si60分子中,外面的硅原子与里面的碳原子以共价键结合,下列叙说不正确的是( )
| A. | 该反应为置换反应 | B. | 该晶体为分子晶体 | ||
| C. | 该物质是一种新的化合物 | D. | 该物质的相对分子质量是2400 |
17. 如图是酸性介质的氢氧燃料电池构造示意图.关于该电池的说法不正确的是( )
如图是酸性介质的氢氧燃料电池构造示意图.关于该电池的说法不正确的是( )
 如图是酸性介质的氢氧燃料电池构造示意图.关于该电池的说法不正确的是( )
如图是酸性介质的氢氧燃料电池构造示意图.关于该电池的说法不正确的是( )| A. | a极是负极 | B. | 电解质溶液中的H+向b极移动 | ||
| C. | 电子由b通过灯泡流向a | D. | 氢氧燃料电池是环保电池 |
7.下列物质能通过化合反应直接制得的是( )
①FeCl2②H2SO4③NH4NO3④HCl ⑤FeCl3.
①FeCl2②H2SO4③NH4NO3④HCl ⑤FeCl3.
| A. | 只有①②③ | B. | 只有④⑤ | C. | 只有①③④ | D. | 全部 |
14.如图是周期表中短周期的一部分,A、B、C三种元素的原子核外电子数之和等于B原子的质量数,B原子的原子核内质子数等于中子数.下列叙述正确的是( )
| A | C | |
| B |
| A. | 最高价氧化物对应水化物的酸性:C>B | |
| B. | C单质是氧化性最强的非金属单质 | |
| C. | A的氢化物中不可能含有非极性共价键 | |
| D. | B位于第三周期ⅦA族 |
12.下列说法正确的是( )
| A. | 向25mL 沸水中滴加5-6 滴饱和FeCl3溶液(含0.1molFeCl3),得所胶体粒子小于NA | |
| B. | 丁达尔效应是胶体区别于溶液的本质特征 | |
| C. | 硅酸胶体可由饱和硅酸钠溶液中加入过量稀盐酸制得 | |
| D. | 氢氧化铁胶体电泳时阴极颜色加深,证明氢氧化铁胶体带正电 |

 .
.

 ;吡啶与混酸(浓硝酸与浓硫酸混合物)在加热条件下,发生硝化反应生成氮原子间位的一取代物的化学方程式为
;吡啶与混酸(浓硝酸与浓硫酸混合物)在加热条件下,发生硝化反应生成氮原子间位的一取代物的化学方程式为 .
.
 .
.
 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的量随时间变化的曲线如图所示:从反应开始到10s,X的物质的量减少了0.8 mol,Z的物质的量浓度增大了0.8 mol/L,用Z表示的反应速率为0.08 mol/(L•s).
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的量随时间变化的曲线如图所示:从反应开始到10s,X的物质的量减少了0.8 mol,Z的物质的量浓度增大了0.8 mol/L,用Z表示的反应速率为0.08 mol/(L•s).