题目内容
实验室需配制一种仅含五种离子(水电离出的离子可忽略)的混合溶液,且在混合溶液中五种离子的物质的量浓度均为1mol/L,下面四个选项中能达到此目的是( )
| A、Ca2+、K+、OH-、Cl-、NO3- |
| B、Fe2+、H+、Br+、NO3-、Cl- |
| C、Na+、NH4+、SO42-、NO3-、Cl- |
| D、Al3+、H+、Cl-、SO42-、NO3- |
考点:离子共存问题
专题:离子反应专题
分析:A.钙离子与氢氧化钙反应生成污染物氢氧化钙,在溶液中不能大量共存;
B.硝酸根离子在酸性条件下具有强氧化性,能够氧化亚铁离子,在溶液中不能大量共存;
C.当物种离子的浓度相等时,违反了电荷守恒;
D.Al3+、H+、Cl-、SO42-、NO3-离子之间不发生反应,且满足溶液电中性.
B.硝酸根离子在酸性条件下具有强氧化性,能够氧化亚铁离子,在溶液中不能大量共存;
C.当物种离子的浓度相等时,违反了电荷守恒;
D.Al3+、H+、Cl-、SO42-、NO3-离子之间不发生反应,且满足溶液电中性.
解答:
解:A.Ca2+与OH-能形成氢氧化钙微溶物,在溶液中不能大量共存,故A错误;
B.Fe2+、H+与NO3-发生氧化还原反应,3Fe2++4H++NO3-=3Fe3++NO↑+2H2O,所以该组离子不能大量共存,故B错误;
C.根据溶液呈电中性,阳离子Na+、K+所带的正电荷总数等于阴离子SO42-、NO3-、Cl-所带的负电荷总数,因体积一定所以需C(Na+)+C(K+)=c(Cl-)+c(NO3-)+2c(SO42-),在混合溶液中五种离子的物质的量浓度均为1mol/L,c(Na+)+c(K+)=2mol/L,c(Cl-)+c(NO3-)+2c(SO42-)=4mol/L,阳离子Na+、K+所带的正电荷总数不等于阴离子SO42-、NO3-、Cl-所带的负电荷总数,故C错误;
D.Al3+、H+、Cl-、SO42-、NO3-离子之间不反应,则能大量共存,根据溶液呈电中性,阳离子Al3+、H+所带的正电荷总数须等于阴离子Cl-、SO42-、NO3-所带的负电荷总数,在混合溶液中五种离子的物质的量浓度均为1mol/L,3c(Al3+)+c(H+)=4mol/L,c(Cl-)+c(NO3-)+2c(SO42-)=4mol/L,阳离子Al3+、Na+所带的正电荷总数等于阴离子Cl-、SO42-、NO3-所带的负电荷总数,故D正确;
故选D.
B.Fe2+、H+与NO3-发生氧化还原反应,3Fe2++4H++NO3-=3Fe3++NO↑+2H2O,所以该组离子不能大量共存,故B错误;
C.根据溶液呈电中性,阳离子Na+、K+所带的正电荷总数等于阴离子SO42-、NO3-、Cl-所带的负电荷总数,因体积一定所以需C(Na+)+C(K+)=c(Cl-)+c(NO3-)+2c(SO42-),在混合溶液中五种离子的物质的量浓度均为1mol/L,c(Na+)+c(K+)=2mol/L,c(Cl-)+c(NO3-)+2c(SO42-)=4mol/L,阳离子Na+、K+所带的正电荷总数不等于阴离子SO42-、NO3-、Cl-所带的负电荷总数,故C错误;
D.Al3+、H+、Cl-、SO42-、NO3-离子之间不反应,则能大量共存,根据溶液呈电中性,阳离子Al3+、H+所带的正电荷总数须等于阴离子Cl-、SO42-、NO3-所带的负电荷总数,在混合溶液中五种离子的物质的量浓度均为1mol/L,3c(Al3+)+c(H+)=4mol/L,c(Cl-)+c(NO3-)+2c(SO42-)=4mol/L,阳离子Al3+、Na+所带的正电荷总数等于阴离子Cl-、SO42-、NO3-所带的负电荷总数,故D正确;
故选D.
点评:本题考查离子共存的判断,为高考中的高频题,题目难度中等,注意明确离子不能大量共存的一般情况,如:能发生复分解反应的离子之间; 能发生氧化还原反应的离子之间等;本题中还要注意溶液电中性特点,试题有利于培养学生的分析、理解能力及灵活应用所学知识的能力.

练习册系列答案
相关题目
下列说法不正确的是( )
| A、塑料袋在全球“失宠”,有偿使用成为风尚,是因为塑料袋填埋占用土地,且难以降解 |
| B、酶催化反应具有高效、专一、条件温和等特点,化学模拟生物酶对绿色化学、环境保护及节能减排具有重要意义 |
| C、2012年诺贝尔化学奖授予两位美国科学家罗伯特?莱夫科维茨和布莱恩?克比尔卡,以表彰他们在“G蛋白偶联受体研究”中取得的重大成就 |
| D、道尔顿、李比希、汤姆生、卢瑟福、玻尔等科学家的研究不断更新人们对原子结构的认识 |
下列实验操作,正确的是( )
| A、中和滴定时,用标准液润洗滴定管,用待测液润洗锥形瓶,并滴入l mL指示剂 |
| B、配制物质的量浓度溶液时,将称量好的溶质溶于盛有适量水的烧杯中,溶解后立即倾入容量瓶中,继续进行洗涤和定容 |
| C、制取Fe(OH)2时,吸取NaOH溶液的胶头滴管的末端应插入FeSO4溶液中,再缓缓将NaOH溶液挤出 |
| D、溴乙烷和烧碱溶液共热后,将硝酸银溶液滴入水解液中,即可见到淡黄色沉淀 |
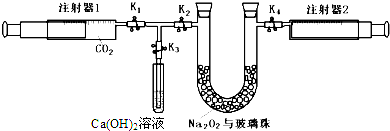
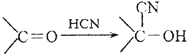
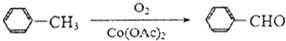
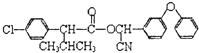 );
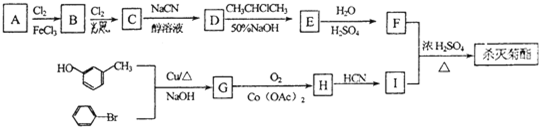
);
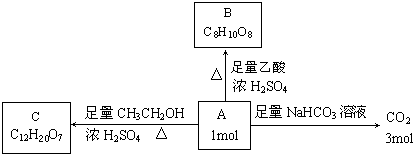
 (1)某矿石由几种常见氧化物组成,组成这些氧化物的元素在地壳中的含量都很丰富.向该矿石混合粉末中加入过量的氢氧化钠溶液,过滤得可用作红色涂料的红棕色固体和无色溶液,然后向所得溶液中滴入盐酸,所得沉淀的质量与所加盐酸的体积的关系如图所示:
(1)某矿石由几种常见氧化物组成,组成这些氧化物的元素在地壳中的含量都很丰富.向该矿石混合粉末中加入过量的氢氧化钠溶液,过滤得可用作红色涂料的红棕色固体和无色溶液,然后向所得溶液中滴入盐酸,所得沉淀的质量与所加盐酸的体积的关系如图所示: