题目内容
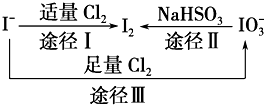 碘在地壳中主要以NaIO3的形式存在,在海水中主要以I-的形式存在,几种微粒之间有如图所示关系(已知:NaHSO3做还原剂,被氧化为Na2SO4),根据图示转化关系推测下列说法不正确的是( )
碘在地壳中主要以NaIO3的形式存在,在海水中主要以I-的形式存在,几种微粒之间有如图所示关系(已知:NaHSO3做还原剂,被氧化为Na2SO4),根据图示转化关系推测下列说法不正确的是( )| A、海带中提取碘过程中,将I-氧化成I2所通入的Cl2不宜过量 |
| B、足量Cl2能使湿润的KI淀粉试纸先变蓝后变白的原因可能是:5Cl2+I2+6H2O═2HIO3+10HCl |
| C、由图可知氧化性的强弱顺序为Cl2>I2>IO3- |
| D、途径Ⅱ中若生成1 mol I2,反应中转移的电子数为10NA |
考点:氯、溴、碘及其化合物的综合应用
专题:
分析:A.根据图中转化关系知Cl2可以把I-氧化成IO3-;
B.根据图示转化Ⅲ可知Cl2>NaIO3,氯气可以将碘氧化HIO3;
C.由途径I可知氧化性Cl2>I2,由途径Ⅱ可知氧化性I2<NaIO3,由途径Ⅲ可知氧化性Cl2>NaIO3;
D.根据转化关系2IO3-~I2~10e-计算判断.
B.根据图示转化Ⅲ可知Cl2>NaIO3,氯气可以将碘氧化HIO3;
C.由途径I可知氧化性Cl2>I2,由途径Ⅱ可知氧化性I2<NaIO3,由途径Ⅲ可知氧化性Cl2>NaIO3;
D.根据转化关系2IO3-~I2~10e-计算判断.
解答:
解:A.根据图中转化关系知Cl2可以把I-氧化成IO3-,将I-氧化成I2,通入的Cl2不宜过量,故A正确;
B.根据图示转化Ⅲ可知Cl2>NaIO3,已变蓝的淀粉-KI试纸褪色的原因可能是氯气将碘氧化为HIO3,反应方程式为5Cl2+I2+6H2O═2HI03+10HCl,故B正确;
C.由途径I可知氧化性Cl2>I2,由途径Ⅱ可知氧化性I2<NaIO3,由途径Ⅲ可知氧化性Cl2>NaIO3,故氧化性的强弱顺序为Cl2>IO3->I2,故C错误;
D.根据转化关系2IO3-~I2~10e-可知,生成1 molI2反应中转移的电子数为10NA,故D正确;
故选C.
B.根据图示转化Ⅲ可知Cl2>NaIO3,已变蓝的淀粉-KI试纸褪色的原因可能是氯气将碘氧化为HIO3,反应方程式为5Cl2+I2+6H2O═2HI03+10HCl,故B正确;
C.由途径I可知氧化性Cl2>I2,由途径Ⅱ可知氧化性I2<NaIO3,由途径Ⅲ可知氧化性Cl2>NaIO3,故氧化性的强弱顺序为Cl2>IO3->I2,故C错误;
D.根据转化关系2IO3-~I2~10e-可知,生成1 molI2反应中转移的电子数为10NA,故D正确;
故选C.
点评:本题综合考查卤素单质及其化合物的性质,侧重于考查氧化性强弱比较及应用,难度中等,根据转化关系判断氧化性强弱是解题关键.

练习册系列答案
相关题目
在一定条件下,反应2HI(g)?H2(g)+I2(g(正反应吸热)达到平衡时,要使混合气体的颜色加深,有以下措施:①增大氢气的浓度 ②升高温度 ③降低温度 ④缩小体积 ⑤增大HI的浓度 ⑥减小压强,其中可采取的有( )
| A、1种 | B、2种 | C、3种 | D、4种 |
一氧化碳中毒,是由于一氧化碳跟血液里的血红蛋白结合,使血红蛋白不能很好地跟氧气结合,人因缺少氧气而窒息,甚至死亡.这个反应可表示如下:(血红蛋白-O2)+CO?(血红蛋白-CO)+O2,抢救中毒者采取的措施不正确的是( )
| A、立即打开门窗通风 |
| B、将中毒者转移到空旷的地带 |
| C、立即打开排气扇将CO排出 |
| D、给危重病人及时输氧 |
将标准状况下aLHCl溶于1L水中,得到的盐酸密度为bg/cm3,则该盐酸的物质的量浓度是( )
A、
| ||
B、
| ||
C、
| ||
D、
|
将标准状况下,将22.4L NH3气体溶于83mL水中,所得溶液密度为0.88g/cm3,则此溶液的物质的量浓度(mol/L)为( )
| A、8.0 mol/L |
| B、8.8 mol/L |
| C、9.0 mol/L |
| D、9.2 mol/L |
现有pH=3的醋酸和pH=3的硫酸两种溶液,下列有关这两种溶液的叙述正确的是( )
| A、两溶液中水电离出的c(H+)=1×10-11mol?L-1 |
| B、加水稀释100倍后两溶液pH仍相同 |
| C、醋酸中的c(CH3COO-)和硫酸中的c(SO42-)相同 |
| D、两溶液中分别加入足量锌片放出H2体积相同 |