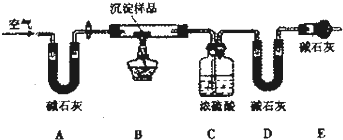
题目内容
将标准状况下aLHCl溶于1L水中,得到的盐酸密度为bg/cm3,则该盐酸的物质的量浓度是( )
A、
| ||
B、
| ||
C、
| ||
D、
|
考点:物质的量浓度的相关计算
专题:
分析:根据n=
计算HCl的物质的量,根据m=nM计算HCl的质量,根据m=ρV计算水的质量,进而计算溶液质量分数,再根据c=
计算.
| V |
| Vm |
| 1000ρω |
| M |
解答:
解:标准状况下,aLHCl的物质的量为
=
mol,其质量为
mol×36.5g/mol=
g,1L水的质量为1000g,溶液质量分数为
=
,得到的盐酸密度为bg/cm3,则该盐酸的物质的量浓度是
mol/L=
mol/L,
故选C.
| aL |
| 22.4L/mol |
| a |
| 22.4 |
| a |
| 22.4 |
| 36.5a |
| 22.4 |
| ||
1000g+
|
| 36.5a |
| 22400+36.5a |
1000×b×
| ||
| 36.5 |
| 1000ab |
| 22400+36.5a |
故选C.
点评:本题考查物质的量浓度有关计算,属于字母型计算,为易错题目,可以利用定义式进行计算,注意理解掌握物质的量浓度与质量分数之间的关系.

练习册系列答案
相关题目
葡萄糖的结构简式为CH2OH-CHOH-CHOH-CHOH-CHOH-CHO,下列关于葡萄糖的说法错误的是( )
| A、葡萄糖是单糖 |
| B、含有5个羟基(-OH) |
| C、含有1个醛基(-CHO) |
| D、含有1个羧基(-COOH) |
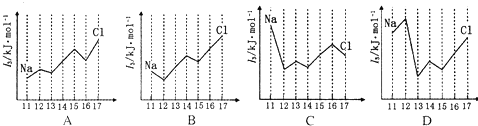
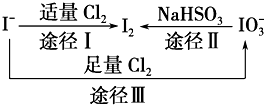 碘在地壳中主要以NaIO3的形式存在,在海水中主要以I-的形式存在,几种微粒之间有如图所示关系(已知:NaHSO3做还原剂,被氧化为Na2SO4),根据图示转化关系推测下列说法不正确的是( )
碘在地壳中主要以NaIO3的形式存在,在海水中主要以I-的形式存在,几种微粒之间有如图所示关系(已知:NaHSO3做还原剂,被氧化为Na2SO4),根据图示转化关系推测下列说法不正确的是( )| A、海带中提取碘过程中,将I-氧化成I2所通入的Cl2不宜过量 |
| B、足量Cl2能使湿润的KI淀粉试纸先变蓝后变白的原因可能是:5Cl2+I2+6H2O═2HIO3+10HCl |
| C、由图可知氧化性的强弱顺序为Cl2>I2>IO3- |
| D、途径Ⅱ中若生成1 mol I2,反应中转移的电子数为10NA |
在一定体积的18mol/L的浓硫酸中加入过量铜片并加热,被还原的硫酸为0.9mol,则浓H2SO4的实际体积( )
| A、等于50mL |
| B、大于50mL |
| C、等于100mL |
| D、大于100mL |
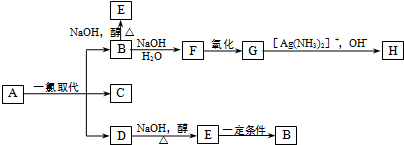
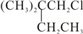 .B和D分别与强碱的醇溶液共热,都只能得到有机化合物E.以上反应及B的进一步反应如图所示.
.B和D分别与强碱的醇溶液共热,都只能得到有机化合物E.以上反应及B的进一步反应如图所示.