题目内容
11.宇宙飞船上的氢氧燃料电池,两个电极均由多孔碳制成(如图),其电池反应为:2H2+O2=2H2O,则a为负极;写出该电池负极电极反应:2H2-4e-+4OH-=4H2O,若电解质溶液改为硫酸时,写出该电池的正极电极反应式:O2+4e-+4H+=2H2O.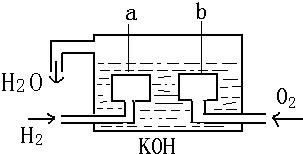
分析 氢氧燃料电池中,原电池工作时,氢氧燃料电池的总反应为2H2+O2=2H2O;通入氢气的一极a为电源的负极,发生氧化反应,通入氧气的一极b为原电池的正极,发生还原反应;若电解质溶液改为硫酸,正极上氧气得电子生成水,据此分析.
解答 解:氢氧燃料电池中,通入氢气的一极为电源的负极,通入氧气的一极为原电池的正极,由于电解质溶液呈碱性,则负极电极反应式为:2H2-4e-+4OH-=4H2O;
若电解质溶液改为硫酸,正极上氧气得电子生成水,其电极反应为:O2+4e-+4H+=2H2O;
故答案为:负;2H2-4e-+4OH-=4H2O;O2+4e-+4H+=2H2O.
点评 本题考查原电池中的氢氧燃料电池的工作原理,题目难度不大,注意电极方程式的书写以及电解质溶液的酸碱性.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目
14.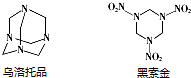 黑索金是一种爆炸力极强的烈性炸药,比TNT猛烈1.5倍.可用浓硝酸硝解乌洛托品得到黑索金,同时生成硝酸铵和甲醛(HCHO).则反应中乌洛托品与硝酸的物质的量之比为( )
黑索金是一种爆炸力极强的烈性炸药,比TNT猛烈1.5倍.可用浓硝酸硝解乌洛托品得到黑索金,同时生成硝酸铵和甲醛(HCHO).则反应中乌洛托品与硝酸的物质的量之比为( )
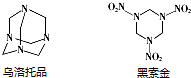 黑索金是一种爆炸力极强的烈性炸药,比TNT猛烈1.5倍.可用浓硝酸硝解乌洛托品得到黑索金,同时生成硝酸铵和甲醛(HCHO).则反应中乌洛托品与硝酸的物质的量之比为( )
黑索金是一种爆炸力极强的烈性炸药,比TNT猛烈1.5倍.可用浓硝酸硝解乌洛托品得到黑索金,同时生成硝酸铵和甲醛(HCHO).则反应中乌洛托品与硝酸的物质的量之比为( )| A. | 1:3 | B. | 1:4 | C. | 2:3 | D. | 2:5 |
2.根据下列实验和现象,所得实验结论正确的是( )
| 实验 | 现象 | 实验结论 | |
| A | 向某溶液中先滴加适量稀硝酸,再滴加少量BaCl2溶液 | 出现白色沉淀 | 原溶液中含有SO42-,SO32-,HSO3-中的一种或几种 |
| B | 将纯碱和硫酸反应生成的气体,通入一定浓度Na2SiO3溶液中 | 出现白色胶状沉淀 | 酸性:H2SO4>H2CO3>H2SiO3 |
| C | 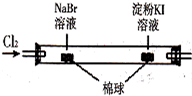 | 左边棉球变为橙色,右边棉球变为蓝色 | 氧化性:Cl2>Br2>I2 |
| D | 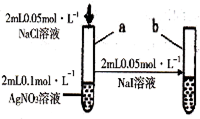 | 试管a出现白色沉淀,试管b出现黄色沉淀 | 溶度积:KSP(AgCl)>KSP(AgI) |
| A. | A | B. | B | C. | C | D. | D |
6.①以下表格中实验记录正确的是C
②将SO2通入BaCl2溶液中以后,再加入以下AB物质可以改变实验现象
A.NH3 B.Cl2 C.H2 D.HCl
②将SO2通入BaCl2溶液中以后,再加入以下AB物质可以改变实验现象
A.NH3 B.Cl2 C.H2 D.HCl
| 实验 | 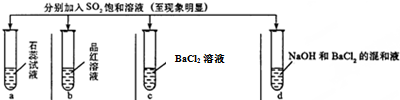 | ||||
| 记录 | A | 无色 | 无色 | 无现象 | 无色溶液 |
| B | 红色 | 无色 | 白色沉淀 | 白色沉淀 | |
| C | 红色 | 无色 | 无色溶液 | 白色沉淀 | |
| D | 无色 | 无色 | 无色溶液 | 无色溶液 | |
16.下列每组中各有三对物质,它们都能用分液漏斗分离的是( )
| A. | 乙酸乙酯和水,酒精和水,植物油和水 | |
| B. | 四氯化碳和水,溴苯和水,硝基苯和水 | |
| C. | 甘油和水,乙酸和水,乙酸和乙醇 | |
| D. | 汽油和水,苯和甲苯,己烷和水 |
3.一定温度下,l mol X和n mol Y在体积为2L的密闭容器中发生如下反应:X(g)+Y(g)?2Z(g)+M(s),5min后达到平衡,此时生成2a mol Z.下列说法正确的是( )
| A. | 当混合气体的平均摩尔质量不再发生变化时,说明反应达到平衡状态 | |
| B. | 用X表示5 min内此反应的反应速率是(0.1-0.2a)mol•(L•min)-1 | |
| C. | 向平衡后的体系中加入l mol M,v(逆)增大,v(正)减小,平衡逆向移动 | |
| D. | 若平衡后再充入l mol X和(n+1)mol Y,再次达平衡时X的物质的量大于(2-2a)mol |
1.下列各化合物的命名中正确的是( )
| A. | CH2=CH-CH=CH21,3-二丁烯 | B. | CH3COOCH2CH2OOCCH3乙二酸二乙酯 | ||
| C. | 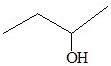 3-丁醇 3-丁醇 | D. | 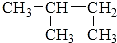 2-甲基丁烷 2-甲基丁烷 |