题目内容
19.NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛.请回答下列问题:
(1)NH4Al(SO4)2可作净水剂,其理由是(用离子方程式表示)Al3+水解生成的Al(OH)3胶体,具有吸附性,即Al3++3H2O═Al(OH)3胶体+3H+,Al(OH)3吸附悬浮颗粒使其沉降从而净化水.
(2)相同条件下,0.1mol•L-1NH4Al(SO4)2中c(NH4+)小于 (填“等于”、“大于”或
“小于”)0.1mol•L-1NH4HSO4中c(NH4+).
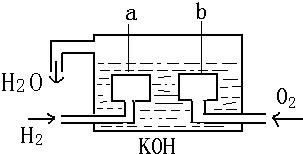
(3)如图1是0.1mol•L-1电解质溶液的pH随温度变化的图象.
①其中符合0.1mol•L-1NH4Al(SO4)2的pH随温度变化的曲线是Ⅰ,导致pH随温度变化的原因是NH4Al(SO4)2水解,溶液呈酸性,升高温度,其水解程度增大,pH减小;
②20℃时,0.1mol•L-1NH4Al(SO4)2中 2c(SO42-)-c(NH4+)-3c(Al3+)=10-3 mol•L-1
(4)室温时,向100mL 0.1mol•L-1NH4HSO4溶液中滴加0.1mol•L-1NaOH 溶液,得到溶液pH与NaOH溶液体积的关系曲线如图2所示:试分析图中a、b、c、d四个点,水的电离程度最大的是a;在b点,溶液中各离子浓度由大到小的排列顺序是c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+).
分析 (1)Al3+水解生成的Al(OH)3胶体,具有吸附性;
(2)铝离子、氢离子抑制铵根离子水解,且铝离子抑制程度小于氢离子;
(3)①NH4Al(SO4)2水解,溶液呈酸性,升高温度其水解程度增大;
②根据电荷守恒定律解题;
(4)a、b、c、d四个点,根据反应量的关系,a点恰好消耗完H+,溶液中只有(NH4)2SO4与Na2SO4;b、c、d三点溶液均含有NH3•H2O,(NH4)2SO4可以促进水的电离,而NH3•H2O抑制水的电离.b点溶液呈中性.
解答 解:(1)Al3+水解生成的Al(OH)3胶体,具有吸附性,离子方程式:Al3++3H2O═Al(OH)3胶体+3H+,
故答案为:Al3+水解生成的Al(OH)3胶体,具有吸附性,即Al3++3H2O═Al(OH)3胶体+3H+,Al(OH)3吸附悬浮颗粒使其沉降从而净化水;
(2)NH4Al(SO4)2与NH4HSO4中的NH4+均发生水解,但是NH4Al(SO4)2中Al3+水解呈酸性抑制NH4+水解,HSO4-电离出H+同样抑制NH4+水解,因为HSO4-电离生成的H+浓度比Al3+水解生成的H+浓度大,所以NH4HSO4中NH4+水解程度比NH4Al(SO4)2中的小,铵根离子浓度大,
故答案为:小于;
(3)①NH4Al(SO4)2水解,溶液呈酸性,升高温度其水解程度增大,pH减小,符合的曲线为Ⅰ,
故答案为:Ⅰ;NH4Al(SO4)2水解,溶液呈酸性,升高温度,其水解程度增大,pH减小;
②根据电荷守恒,可以求出2c(SO42-)-c(NH4+)-3c(Al3+)=c(H+)-c(OH-)=10-3 mol•L-1[c(OH-)太小,可忽略],
故答案为:10-3 mol•L-1;
(4)a、b、c、d四个点,根据反应量的关系,a点恰好消耗完H+,溶液中只有(NH4)2SO4与Na2SO4;b、c、d三点溶液均含有NH3•H2O,(NH4)2SO4可以促进水的电离,而NH3•H2O抑制水的电离.b点溶液呈中性,即溶液含有(NH4)2SO4、Na2SO4、NH3•H2O三种成分,a点时c(Na+)=c(SO42-),b点时c(Na+)>c(SO42-),根据N元素与S元素的关系,可以得出c(SO42-)>c(NH4+),故c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+),
故答案为:a;c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+).
点评 本题考查盐类的水解和离子浓度大小的比较,题目难度中等,注意根据守恒思想解题和图象变化特征是解题关键.

| A. | 0.1mol•L-1的NH4NO3溶液中含有的氮原子数为0.2NA | |
| B. | 1 mol氯气分别与足量铁和铝完全反应时转移的电子数均为3NA | |
| C. | 16g O2和16g O3均含有NA个氧原子 | |
| D. | 25℃时1L pH=1的H2SO4溶液中含有H+的数目为0.2NA |
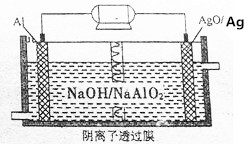 我国“蛟龙”号载入潜水器进行第五次下潜试验,最大深度达到7062米,并完全返回.其动力电源是Al-AgO电池,原理如图所示.下列说法中正确的是( )
我国“蛟龙”号载入潜水器进行第五次下潜试验,最大深度达到7062米,并完全返回.其动力电源是Al-AgO电池,原理如图所示.下列说法中正确的是( )| A. | Al电极是该电池的正极 | |
| B. | Ag在AgO/Ag电极上发生氧化反应 | |
| C. | 该电池负极反应是2Al-6e-+8OH-═2AlO2-+4H2O | |
| D. | AgO/Ag电极溶液中的pH减小 |
| X | Y | ||
| Z | W | Q |
| A. | 由Y与W形成的氧化物溶于水一定是强酸 | |
| B. | X与Y能形成两种常见的化合物 | |
| C. | Z与Q形成的物质能与H2在一定条件下反应 | |
| D. | X和Y均存在同素异形体 |
| A. | 氯原子: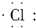 | B. | OH-离子: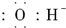 | ||
| C. | NH3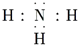 | D. | HCl的形成过程: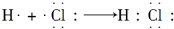 |
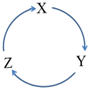 下列各物质中,不能按如图(“→”表示一步完成)关系相互转化的是( )
下列各物质中,不能按如图(“→”表示一步完成)关系相互转化的是( )| 选项 | X | Y | Z |
| A | Fe | FeCl3 | FeCl2 |
| B | Cl2 | NaClO | NaCl |
| C | Si | SiO2 | H2SiO3 |
| D | HNO3 | NO | NO2 |
| A. | A | B. | B | C. | C | D. | D |
完成下列填空:
(1)R原子的电子排布式是1s22s22p63s23p2;X所在周期元素最高价氧化物对应的水化物中,酸性最强的是HNO3;Z的氢化物的水溶液可用于雕刻玻璃;Q、R、U的单质形成的晶体,熔点由高到低的排列顺序是Si>Mg>Cl2.
(2)CuSO4能用作T4中毒的解毒剂,反应可生成T的最高价含氧酸和铜,该反应的化学方程式是10CuSO4+P4+16H2O→4H3PO4+10Cu+10H2SO4.
在pH为4~5的环境中,Cu2+、Fe2+不生成沉淀,而Fe3+几乎完全沉淀.工业上制CuCl2是将浓盐酸用蒸汽加热到80℃左右,再慢慢加入粗氧化铜(含FeO),充分搅拌使之溶解.
(3)除去该溶液中杂质离子的方法是在溶液中通入Cl2,再加入CuO粉末调节pH为4~5.
碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
| 化学键 | C-C | C-H | Si-Si | Si-H |
| 键能(KJ/mol) | 356 | 413 | 226 | 318 |
第三周期部分元素氟化物的熔点如下:
| 氟化物 | NaF | MgF2 | SiF4 |
| 熔点/K | 1266 | 1534 | 183 |
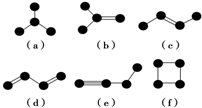 如图是由4个碳原子结合成的6种有机物(氢原子没有画出).
如图是由4个碳原子结合成的6种有机物(氢原子没有画出).