题目内容
3.一定温度下,l mol X和n mol Y在体积为2L的密闭容器中发生如下反应:X(g)+Y(g)?2Z(g)+M(s),5min后达到平衡,此时生成2a mol Z.下列说法正确的是( )| A. | 当混合气体的平均摩尔质量不再发生变化时,说明反应达到平衡状态 | |
| B. | 用X表示5 min内此反应的反应速率是(0.1-0.2a)mol•(L•min)-1 | |
| C. | 向平衡后的体系中加入l mol M,v(逆)增大,v(正)减小,平衡逆向移动 | |
| D. | 若平衡后再充入l mol X和(n+1)mol Y,再次达平衡时X的物质的量大于(2-2a)mol |
分析 A.随反应进行,反应混合气体的质量减小,混合气体的质量不变,说明到达平衡;
B.5min后达到平衡,此时生成2a mol Z,则消耗2amolX;
C.M为固体,对反应速率基本没有影响;
D.对应反应X(g)+Y(g)?2Z(g)+M(s),前后气体的物质的量不变,在温度不变的情况下,加入X、Y按1:n投入,则达到相同平衡状态.
解答 解:A.M为固体,随反应进行,反应混合气体的质量减小,混合气体的质量不变,则混合气体的平均摩尔质量不变,可说明到达平衡,故A正确;
B.5min后达到平衡,此时生成2a mol Z,则消耗amolX,用X表示5 min内此反应的反应速率是$\frac{\frac{amol}{2L}}{5min}$=0.1amol•(L•min)-1,故B错误;
C.M为固体,对反应速率基本没有影响,故C错误;
D.对应反应X(g)+Y(g)?2Z(g)+M(s),前后气体的物质的量不变,在温度不变的情况下,加入X、Y按1:n投入,则达到相同平衡状态,但再充入l mol X和(n+1)mol Y,则不能达到相同平衡状态,促进平衡正向移动,再次达平衡时X的物质的量小于于(2-2a)mol,故D错误.
故选A.
点评 本题主要考查了化学反应速率、化学平衡移动、化学平衡状态判断等,为高考常见题型和高频考点,侧重于学生的分析、计算能力的考查,难度不大,注意对基础知识的理解掌握.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
6.下列物质的熔点,前者大于后者的是( )
| A. | 晶体硅、碳化硅 | B. | 氯化钠、甲苯 | C. | 氧化钠、氧化镁 | D. | 钾钠合金、钠 |
14.短周期元素X、Y、Z、W、Q在元素周期表中的位置如表所示,其中X元素的原子内层电子数是最外层电子数的一半,则下列说法中不正确的是( )
| X | Y | ||
| Z | W | Q |
| A. | 由Y与W形成的氧化物溶于水一定是强酸 | |
| B. | X与Y能形成两种常见的化合物 | |
| C. | Z与Q形成的物质能与H2在一定条件下反应 | |
| D. | X和Y均存在同素异形体 |
18.下列化合物分子中的所有原子都处于同一平面的是( )
| A. | 溴苯 | B. | 对二甲苯 | C. | 丙炔 | D. | 丙烯 |
8. 下列各物质中,不能按如图(“→”表示一步完成)关系相互转化的是( )
下列各物质中,不能按如图(“→”表示一步完成)关系相互转化的是( )
 下列各物质中,不能按如图(“→”表示一步完成)关系相互转化的是( )
下列各物质中,不能按如图(“→”表示一步完成)关系相互转化的是( )| 选项 | X | Y | Z |
| A | Fe | FeCl3 | FeCl2 |
| B | Cl2 | NaClO | NaCl |
| C | Si | SiO2 | H2SiO3 |
| D | HNO3 | NO | NO2 |
| A. | A | B. | B | C. | C | D. | D |
15.己知A、B、C、D的原子序数都不超过18,它们的离子aA(n+l)+、bBn+、.cC(n+l)-、dDn-均具有相同的电子层结构,则下列叙述正确的是( )
| A. | 原子序数:a>b>c>d | B. | 离子半径:C(n+1)->Dn->A(n+1)+>Bn+ | ||
| C. | 单质还原性:B>A,氧化性:D>C | D. | 原子半径:A>B>C>D |


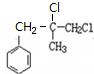 .
. +2NaOH $→_{△}^{水}$
+2NaOH $→_{△}^{水}$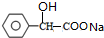 +NaCl+H2O.其反应类型为水解反应、中和反应.
+NaCl+H2O.其反应类型为水解反应、中和反应.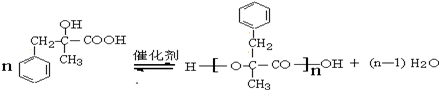 .
. ,而不是
,而不是 或
或 的原因是因为该条件下与双键相连的甲基上的氢原子更易取代.
的原因是因为该条件下与双键相连的甲基上的氢原子更易取代.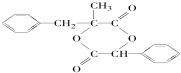 .
.