题目内容
20.铷和另一种碱金属形成的合金7.8g与足量的水反应后,产生0.2g氢气,则此合金中另一种碱金属为哪种元素?(铷的相对原子量取85.5)(写出计算过程)分析 钾和另一种碱金属在化合物中的化合价均为+1价,由2M+2H2O═2MOH+H2↑计算出金属的物质的量,再计算出合金的平均摩尔质量,利用平均摩尔质量的进行判断.
解答 解:0.2g氢气的物质的量为:$\frac{0.2g}{2g/mol}$=0.1mol,则
2M+2H2O═2MOH+H2↑,
2 1
0.2mol 0.1mol
则合金的平均摩尔质量为:M=$\frac{7.8g}{0.2mol}$=39g/mol,
铷的相对原子量取85.5,铷的摩尔质量为85.5g/mol,则另一种碱金属的摩尔质量一定小于39g/mol,
故另一碱金属可能是Li或Na,
答:此合金中另一种碱金属为Li或Na.
点评 本题考查了混合物反应的计算,题目难度中等,明确平均摩尔质量的含义及应用方法为解答关键,注意掌握碱金属元素的种类及化学性质,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案
相关题目
3.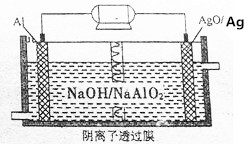 我国“蛟龙”号载入潜水器进行第五次下潜试验,最大深度达到7062米,并完全返回.其动力电源是Al-AgO电池,原理如图所示.下列说法中正确的是( )
我国“蛟龙”号载入潜水器进行第五次下潜试验,最大深度达到7062米,并完全返回.其动力电源是Al-AgO电池,原理如图所示.下列说法中正确的是( )
 我国“蛟龙”号载入潜水器进行第五次下潜试验,最大深度达到7062米,并完全返回.其动力电源是Al-AgO电池,原理如图所示.下列说法中正确的是( )
我国“蛟龙”号载入潜水器进行第五次下潜试验,最大深度达到7062米,并完全返回.其动力电源是Al-AgO电池,原理如图所示.下列说法中正确的是( )| A. | Al电极是该电池的正极 | |
| B. | Ag在AgO/Ag电极上发生氧化反应 | |
| C. | 该电池负极反应是2Al-6e-+8OH-═2AlO2-+4H2O | |
| D. | AgO/Ag电极溶液中的pH减小 |
8. 下列各物质中,不能按如图(“→”表示一步完成)关系相互转化的是( )
下列各物质中,不能按如图(“→”表示一步完成)关系相互转化的是( )
 下列各物质中,不能按如图(“→”表示一步完成)关系相互转化的是( )
下列各物质中,不能按如图(“→”表示一步完成)关系相互转化的是( )| 选项 | X | Y | Z |
| A | Fe | FeCl3 | FeCl2 |
| B | Cl2 | NaClO | NaCl |
| C | Si | SiO2 | H2SiO3 |
| D | HNO3 | NO | NO2 |
| A. | A | B. | B | C. | C | D. | D |
15.己知A、B、C、D的原子序数都不超过18,它们的离子aA(n+l)+、bBn+、.cC(n+l)-、dDn-均具有相同的电子层结构,则下列叙述正确的是( )
| A. | 原子序数:a>b>c>d | B. | 离子半径:C(n+1)->Dn->A(n+1)+>Bn+ | ||
| C. | 单质还原性:B>A,氧化性:D>C | D. | 原子半径:A>B>C>D |
5.不同的金属在冶炼方法上也有所不同,下列说法正确的是( )
| A. | 钒、铬、锰、铁等难熔金属通常采用铝热法炼制 | |
| B. | 炼钢和炼铁都是采用还原剂将铁从其化合物中还原出来,区别在于炼钢时选用的还原剂的还原性更强 | |
| C. | 由于钠、镁、铝等金属化学性质太活泼,人们通常采用电解熔融状态下的氯化物的方式来获取它们的单质 | |
| D. | 炼铁时加入的焦炭除了提供热量外,还用来制造还原剂一氧化碳 |
9.X、Z、Q、R、T、U分别代表原子序数依次增大的短周期元素.X和R属同族元素;Z和U位于第VII A族;X和Z可形成化合物XZ4;Q原子的s轨道和p轨道的电子总数相等;T的一种单质在空气中能够自燃.
完成下列填空:
(1)R原子的电子排布式是1s22s22p63s23p2;X所在周期元素最高价氧化物对应的水化物中,酸性最强的是HNO3;Z的氢化物的水溶液可用于雕刻玻璃;Q、R、U的单质形成的晶体,熔点由高到低的排列顺序是Si>Mg>Cl2.
(2)CuSO4能用作T4中毒的解毒剂,反应可生成T的最高价含氧酸和铜,该反应的化学方程式是10CuSO4+P4+16H2O→4H3PO4+10Cu+10H2SO4.
在pH为4~5的环境中,Cu2+、Fe2+不生成沉淀,而Fe3+几乎完全沉淀.工业上制CuCl2是将浓盐酸用蒸汽加热到80℃左右,再慢慢加入粗氧化铜(含FeO),充分搅拌使之溶解.
(3)除去该溶液中杂质离子的方法是在溶液中通入Cl2,再加入CuO粉末调节pH为4~5.
碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
(4)硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是硅烷中的Si-Si键和Si-H键的键能小于烷烃分子中C-C键和C-H键的键能,稳定性差,易断裂,导致长链硅烷难以形成.
第三周期部分元素氟化物的熔点如下:
(5)表中三种氟化物熔点差异的原因是NaF与MgF2为离子晶体,而SiF4为分子晶体,所以NaF与MgF2远比SiF4熔点要高;又因为Mg2+的半径小于Na+的半径,所以MgF2中离子键的强度大于NaF中离子键的强度,故MgF2的熔点高于NaF.
完成下列填空:
(1)R原子的电子排布式是1s22s22p63s23p2;X所在周期元素最高价氧化物对应的水化物中,酸性最强的是HNO3;Z的氢化物的水溶液可用于雕刻玻璃;Q、R、U的单质形成的晶体,熔点由高到低的排列顺序是Si>Mg>Cl2.
(2)CuSO4能用作T4中毒的解毒剂,反应可生成T的最高价含氧酸和铜,该反应的化学方程式是10CuSO4+P4+16H2O→4H3PO4+10Cu+10H2SO4.
在pH为4~5的环境中,Cu2+、Fe2+不生成沉淀,而Fe3+几乎完全沉淀.工业上制CuCl2是将浓盐酸用蒸汽加热到80℃左右,再慢慢加入粗氧化铜(含FeO),充分搅拌使之溶解.
(3)除去该溶液中杂质离子的方法是在溶液中通入Cl2,再加入CuO粉末调节pH为4~5.
碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
| 化学键 | C-C | C-H | Si-Si | Si-H |
| 键能(KJ/mol) | 356 | 413 | 226 | 318 |
第三周期部分元素氟化物的熔点如下:
| 氟化物 | NaF | MgF2 | SiF4 |
| 熔点/K | 1266 | 1534 | 183 |
10.短周期元素A、B可形成A3B2型化合物,若B的原子序数为 b,则A的原子序数不可能为( )
| A. | b-3 | B. | b+5 | C. | b+4 | D. | b一11 |


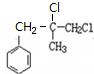 .
. +2NaOH $→_{△}^{水}$
+2NaOH $→_{△}^{水}$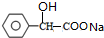 +NaCl+H2O.其反应类型为水解反应、中和反应.
+NaCl+H2O.其反应类型为水解反应、中和反应.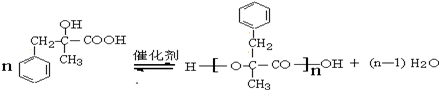 .
. ,而不是
,而不是 或
或 的原因是因为该条件下与双键相连的甲基上的氢原子更易取代.
的原因是因为该条件下与双键相连的甲基上的氢原子更易取代. .
.