题目内容
2.设NA为阿伏加德罗常数的值,下列叙述正确的是( )| A. | 1 L 0.1 mol•L-1的CuCl2溶液中含Cu2+为0.1NA | |
| B. | 标准状况下,22.4 L CCl4含CCl4分子为NA | |
| C. | 1mol H3O+含质子数为10 NA | |
| D. | 1mol Na2O2混合物中含阴离子的数目为NA |
分析 A、铜离子是弱碱阳离子,在溶液中会水解;
B、标况下四氯化碳为液态;
C、H3O+中含11个质子;
D、过氧化钠由2个钠离子和1个过氧根构成.
解答 解:A、铜离子是弱碱阳离子,在溶液中会水解,故溶液中的铜离子的个数小于0.1NA个,故A错误;
B、标况下四氯化碳为液态,故不能根据气体摩尔体积来计算其物质的量和分子个数,故B错误;
C、H3O+中含11个质子,故1mol中含11mol质子即11NA个,故C错误;
D、过氧化钠由2个钠离子和1个过氧根构成,故1mol过氧化钠中含1mol阴离子即NA个,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
13.下列反应的离子方程式书写正确的是( )
| A. | AlCl3溶液中加入过量氨水:Al3++4NH3•H2O═AlO${\;}_{2}^{-}$+4NH${\;}_{4}^{+}$+2H2O | |
| B. | 在海带灰的浸出液(含有I-)中滴加H2O2得到I2:2I-+H2O2+2H+═I2+O2↑+2H2O | |
| C. | 在氢氧化钡溶液中滴加硫酸氢钾溶液至PH=7:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O | |
| D. | 用碳酸钠溶液浸泡锅炉水垢:Ca2++CO32-═CaCO3↓ |
10.下列各反应达到化学平衡后,加压或降温都能使化学平衡向逆反应方向移动的是( )
①2NO2?N2O4 (正反应为放热反应)
②C(s)+CO2?2CO (正反应为吸热反应)
③N2+3H2?2NH3 (正反应为放热反应)
④H2S?H2+S(s)(正反应为吸热反应)
①2NO2?N2O4 (正反应为放热反应)
②C(s)+CO2?2CO (正反应为吸热反应)
③N2+3H2?2NH3 (正反应为放热反应)
④H2S?H2+S(s)(正反应为吸热反应)
| A. | ①③ | B. | ② | C. | ①② | D. | ②③ |
7.CO是一种有毒气体,工业上可利用CO和H2在一定条件下合成有机燃料甲醇,实现变废为宝,节约资源的目的.回答下列问题:
(1)已知:①2H2(g)+O2(g)=2H2O(l)△H1=-571.6kJ•mol-1
②2CO(g)+O2(g)=2CO2(g)△H2=-566.0kJ•mol-1
③CO(g)+2H2(g)=CH3OH(g)△H3=-90.8kJ•mol-1
则表示CH3OH蒸汽燃烧热的热化学方程式为CH3OH(g)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l),△H=-763.8kJ•mol-1.
(2)在一定温度下,按下表中的物质的量投入容积为2L的恒容密闭容器中,发生反应:CO(g)+2H2(g)=CH3OH(g)△H3=-90.8kJ•mol-1,得到如下数据:
①按实验2中的量投入容器,反应向正(填“正”或“逆”)方向进行,达到平衡时CO的转化率为50%(保留一位小数)
②750℃,该反应的平衡常数K=1.56(保留两位小数)
③已知750℃时,若实验4在体积可变的恒压密闭容器中反应,达到平衡时CO的体积分数为W%,相同条件下,若起始时容器中加入xmolCO、ymolH2和0.4molCH3OH气体,达到平衡时,欲保持CO的体积分数仍为W%,则x、y应满足的条件是x:y=1:2(用含x、y的式子表示).
(3)利用甲醇通过如图装置电解精炼铜,请回答下列问题:
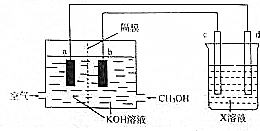
①应选粗铜作d电极的电极材料,C电极的名称为阴极,X溶液为硫酸铜溶液;
②b电极的电极反应式为CH3OH-6e-+8OH-=CO32-+6H2O;
③电解精炼过程中a电极附近溶液的pH会增大(填“增大”、“减小”或“不变”)
(1)已知:①2H2(g)+O2(g)=2H2O(l)△H1=-571.6kJ•mol-1
②2CO(g)+O2(g)=2CO2(g)△H2=-566.0kJ•mol-1
③CO(g)+2H2(g)=CH3OH(g)△H3=-90.8kJ•mol-1
则表示CH3OH蒸汽燃烧热的热化学方程式为CH3OH(g)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l),△H=-763.8kJ•mol-1.
(2)在一定温度下,按下表中的物质的量投入容积为2L的恒容密闭容器中,发生反应:CO(g)+2H2(g)=CH3OH(g)△H3=-90.8kJ•mol-1,得到如下数据:
| 实验组序 | 温度/℃ | 起始量/mol | 平衡量/mol | ||||
| CO(g) | H2(g) | CH3OH(g) | CH3OH(g) | ||||
| 1 | 500 | 2 | 4 | 0 | 1 | ||
| 2 | 500 | 1.4 | 2.8 | 0.6 | a | ||
| 3 | 750 | 0 | 0 | 2 | 0.8 | ||
| 4 | 750 | 0.8 | 1.6 | 1.2 | b | ||
②750℃,该反应的平衡常数K=1.56(保留两位小数)
③已知750℃时,若实验4在体积可变的恒压密闭容器中反应,达到平衡时CO的体积分数为W%,相同条件下,若起始时容器中加入xmolCO、ymolH2和0.4molCH3OH气体,达到平衡时,欲保持CO的体积分数仍为W%,则x、y应满足的条件是x:y=1:2(用含x、y的式子表示).
(3)利用甲醇通过如图装置电解精炼铜,请回答下列问题:

①应选粗铜作d电极的电极材料,C电极的名称为阴极,X溶液为硫酸铜溶液;
②b电极的电极反应式为CH3OH-6e-+8OH-=CO32-+6H2O;
③电解精炼过程中a电极附近溶液的pH会增大(填“增大”、“减小”或“不变”)
14.汽车在现代生活中扮演着越来越重要的角色,但其尾气(碳氢化合物、氮氧化物及一氧化碳等)带来的环境污染越来越明显,汽车尾气的治理已经迫在眉睫.
(1)尾气中的CO主要来自于汽油的不完全燃烧.
①有人设想按下列反应除去CO:2CO(g)═2C(s)+O2(g)△H=+221kJ•mol-1,简述该设想能否实现否(填“是”或“否”)依据是:该反应是焓增、熵减的反应,任何温度下均不能自发进行.
②研究表明:反应CO(g)+H2O(g)?H2(g)+CO2(g)平衡常数随温度的变化如下表所示:
该反应的△H<0(填“>”或“<”)若反应在500℃时进行,设起始时CO和H2O的浓度均为0.020mol•L-1,在该条件下达到平衡时,CO的转化率为75%.
(2)用CO做燃料电池电解NaCl溶液、FeCl3和FeCl2混合液的示意图如图1所示,其中A、B、D均为石墨电极,C为铜电极,转移0.4mol e-后,断开K.
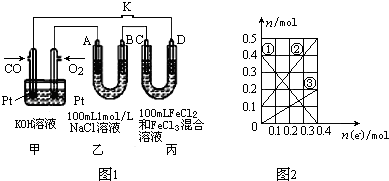
①乙中产生的气体在标准状况下的体积为7.28L.
②丙装置溶液中金属阳离子的物质的量与转移电子的物质的量变化关系如图2所示,反应结束后,要使丙装置中金属阳离子恰好完全沉淀,需要280mL 5.0mol•L-1 NaOH溶液.
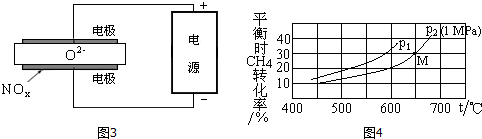
(3)电解法处理氮氧化合物是目前大气污染治理的一个新思路,原理是将NOx在电解池中分解成无污染的N2和O2除去,如图2所示,两电极间是固体氧化物电解质,在一定条件下可自由传导O2-,电解池阴极反应为2NOx+4xe-=N2+2xO2-.
(4)尾气中的碳氢化合物,如甲烷,可以用来制备氢气.其反应方程式为:
CH4(g)+H2O(g)?CO(g)+3H2(g)△H=+206.2kJ/mol
[其中投料比n(CH4):n(H2O)=1:1].
对于气相反应,用某组分(B)的平衡压强(PB)代替物质的量浓度(cB)也可表示平衡常数(记作KP,分压=总压×物质的量分数).平衡时CH4的转化率与温度、压强(总压)的关系如图4所示:
则p1< p2 (填“>”或“<”),p2时M点的平衡常数KP=0.066(小数点后保留3位).
(1)尾气中的CO主要来自于汽油的不完全燃烧.
①有人设想按下列反应除去CO:2CO(g)═2C(s)+O2(g)△H=+221kJ•mol-1,简述该设想能否实现否(填“是”或“否”)依据是:该反应是焓增、熵减的反应,任何温度下均不能自发进行.
②研究表明:反应CO(g)+H2O(g)?H2(g)+CO2(g)平衡常数随温度的变化如下表所示:
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
(2)用CO做燃料电池电解NaCl溶液、FeCl3和FeCl2混合液的示意图如图1所示,其中A、B、D均为石墨电极,C为铜电极,转移0.4mol e-后,断开K.

①乙中产生的气体在标准状况下的体积为7.28L.
②丙装置溶液中金属阳离子的物质的量与转移电子的物质的量变化关系如图2所示,反应结束后,要使丙装置中金属阳离子恰好完全沉淀,需要280mL 5.0mol•L-1 NaOH溶液.
(3)电解法处理氮氧化合物是目前大气污染治理的一个新思路,原理是将NOx在电解池中分解成无污染的N2和O2除去,如图2所示,两电极间是固体氧化物电解质,在一定条件下可自由传导O2-,电解池阴极反应为2NOx+4xe-=N2+2xO2-.

(4)尾气中的碳氢化合物,如甲烷,可以用来制备氢气.其反应方程式为:
CH4(g)+H2O(g)?CO(g)+3H2(g)△H=+206.2kJ/mol
[其中投料比n(CH4):n(H2O)=1:1].
对于气相反应,用某组分(B)的平衡压强(PB)代替物质的量浓度(cB)也可表示平衡常数(记作KP,分压=总压×物质的量分数).平衡时CH4的转化率与温度、压强(总压)的关系如图4所示:
则p1< p2 (填“>”或“<”),p2时M点的平衡常数KP=0.066(小数点后保留3位).
11.以下反应属于加成反应的是( )
| A. | 乙烯使酸性高锰酸钾溶液褪色 | |
| B. | 乙烯使溴的四氯化碳溶液褪色 | |
| C. | 甲烷与氯气混合光照一段时间后黄绿色褪色 | |
| D. | 乙烯在催化剂作用下生成聚乙烯 |