题目内容
20.检验溴乙烷中是否有溴元素,合理的实验方法是( )| A. | 加入氯水后振荡,看水层里是否有棕红色的溴出现 | |
| B. | 加入硝酸银溶液,再加稀硝酸,观察有无浅黄色沉淀生成 | |
| C. | 加入NaOH水溶液共热,冷却后加硝酸银溶液,观察有无浅黄色沉淀生成 | |
| D. | 加入NaOH水溶液共热,冷却后用过量稀硝酸中和过量碱后,再加硝酸银溶液,观察有无浅黄色沉淀生成 |
分析 检验溴乙烷是非电解质,不能电离出溴离子,应在碱性条件下水解,先加入硝酸酸化,再加入硝酸银,观察是否有浅黄色沉淀生成,据此即可解答.
解答 解:检验溴乙烷中含有溴元素首先将它转化为溴离子,采用卤代烃的水解方法,即加入氢氧化钠,在水解后生成的溴离子可以和银离子反应,生成淡黄色不溶于硝酸的溴化银沉淀,由此来检验溴乙烷中的溴元素的方法:加入NaOH溶液共热,冷却后用过量稀硝酸中和过量碱后,再加硝酸银溶液,观察有无浅黄色沉淀生成;
故选:D.
点评 本题是一道考查检验某溴乙烷中的溴元素的实验题,考查实验分析能力,依据相关实验证实即可解答,难度不大.

练习册系列答案
相关题目
11.下列有关说法正确的是( )
| A. | 蛋白质、淀粉、纤维素、葡萄糖等都能在人体内水解并提供能量 | |
| B. | 将甲烷和乙烯的混合气体通过盛有溴水的洗气瓶,即可提纯甲烷 | |
| C. | C2H6与氯气发生取代反应,C2H4与HCl发生加成反应,均可得到C2H5Cl | |
| D. | 用溴水一种试剂就可将苯、CCl4、乙酸、乙醇区别 |
15.已知2-丁烯有顺、反两种同分异构体,在某条件下两种气体处于平衡,下列说法正确的是( )
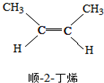 ?
? △H=-4.2kJ/mol.
△H=-4.2kJ/mol.
 ?
? △H=-4.2kJ/mol.
△H=-4.2kJ/mol.| A. | 顺-2-丁烯比反-2-丁烯稳定 | |
| B. | 顺-2-丁烯的燃烧热比反-2-丁烯大 | |
| C. | 降温有利于平衡向生成顺-2-丁烯反应方向移动 | |
| D. | 反-2-丁烯和顺-2-丁烯具有相同的熔沸点 |
5.汽车尾气中的有害物质NO和CO能缓慢起反应,2CO+2NO═N2+2CO2,为了控制大气污染,某同学提出了下列建议,你认为可行的方法是( )
| A. | 改变汽车尾气排放压强 | |
| B. | 提高反应温度 | |
| C. | 在尾气排放处使用催化剂 | |
| D. | 向汽车发动机燃烧室中通入过量的空气 |
12.下列化学用语或举例正确的是( )
| A. | I-131:${\;}_{19}^{39}X$ | B. | Cl-的结构示意图: | ||
| C. | 强电解质:BaSO4 | D. | 碱性氧化物:Na2O2 |
9.有X、Y、Z、W四种金属,已知:①X(OH)3的碱性强于Y(OH)2;②X3+可将Z氧化;③W可与热水反应产生H2,X不能与热水反应;④把X的金属片插入稀H2SO4中,让金属片与Z接触,则X溶解速率加快.下列四种金属活动性强弱关系中一定正确的是( )
| A. | X>Y | B. | W>Z | C. | Z>Y | D. | Z>X |
10.下列化学反应的离子方程式其中正确的是( )
| A. | 碳酸钙与盐酸反应:CO32-+2H+═CO2↑+H2O | |
| B. | 铜和硝酸银溶液反应:Cu+Ag+═Cu2++Ag | |
| C. | 铁与氯化铁溶液反应:Fe+2Fe3+═3Fe2+ | |
| D. | 氢氧化钡溶液与硫酸反应:Ba2++OH-+H++SO42-═BaSO4↓+H2O |
 运用元素周期律研究元素及其化合物的性质具有重要意义.
运用元素周期律研究元素及其化合物的性质具有重要意义. .
.