题目内容
12.下列化学用语或举例正确的是( )| A. | I-131:${\;}_{19}^{39}X$ | B. | Cl-的结构示意图: | ||
| C. | 强电解质:BaSO4 | D. | 碱性氧化物:Na2O2 |
分析 A.元素符号的左上角是质量数,左下角是质子数;
B.阴离子核外电子数=质子数+电荷数;
C.硫酸钡溶于水的部分完全电离,属于强电解质;
D.碱性氧化物与酸反应生成盐和水,过氧化钠与酸反应产物除了盐和水外,还有氧气生成.
解答 解:A.I-131的质量数为131,该核素正确的表示方法为:53131I,故A错误;
B.阴离子核外电子数=质子数+电荷数,Cl-的核外电子数应为18,氯离子正确的结构示意图为 ,故B错误;
,故B错误;
C.BaSO4溶于水的部分完全电离,属于强电解质,故C正确;
D.Na2O2与水反应生成氢氧化钠和氧气,与酸反应生成盐、水和氧气,过氧化钠不属于碱性氧化物,故D错误;
故选C.
点评 本题考查了常见化学用语的表示方法,题目难度中等,涉及离子结构示意图、元素符号、强弱电解质等知识,明确常见化学用语的书写原则为解答关键,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
2. 氮元素的化合物种类繁多,性质也各不相同.
氮元素的化合物种类繁多,性质也各不相同.
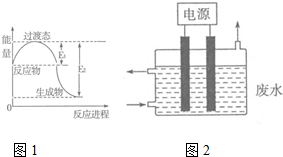
(1)图1为一定温度下1molNO2(g)和1molCO(g)反应生成NO(g)和CO2(g)过程中的能量变化示意图.已知E1=147.5kJ•mol-1,E2=376.2kJ•mol-1(E1、E2为反应的活化能).若在反应体系中加入催化剂,反应速率增大,则E1减小(填“增大”、“减小”或“不变”).该反应的热化学方程式为NO2(g)+CO(g)=NO(g)+CO2(g)△H=-228.7KJ/mol.
(2)硝基苯甲酸乙酯在OH-存在的条件下发生水解反应:
O2NC6H4COOC2H5+OH-?O2NC6H4COOO-+C2H5OH
两种反应物的初始浓度均为0.050mol•L-1,某温度下测得O2NC6H4COOC2H5的转化率α随时间变化的数据如下表所示:
回答下列问题:①该反应在330s~530s的平均反应速率为$\frac{0.05×(73%-59%)}{200}$(只列算式,不做运算)
②为提高O2NC6H4COOC2H5的转化率,可以采取的措施有增加OH-的浓度、移去产物. (写1条即可)
(3)2015年8月12日天津港爆炸中有一定量的氰化物泄露,可用如图2所示装置除去含CN-、Cl-废水中的CN-,控制溶液pH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,该反应的离子方程式为2CN-+5ClO-+H2O═N2↑+2CO2↑+5Cl-+2OH-,,其中两个电极的材料分别为石墨和铁,则石墨作阳极,其电极反应式为Cl-+2OH--2e-═ClO-+H2O.
 氮元素的化合物种类繁多,性质也各不相同.
氮元素的化合物种类繁多,性质也各不相同.(1)图1为一定温度下1molNO2(g)和1molCO(g)反应生成NO(g)和CO2(g)过程中的能量变化示意图.已知E1=147.5kJ•mol-1,E2=376.2kJ•mol-1(E1、E2为反应的活化能).若在反应体系中加入催化剂,反应速率增大,则E1减小(填“增大”、“减小”或“不变”).该反应的热化学方程式为NO2(g)+CO(g)=NO(g)+CO2(g)△H=-228.7KJ/mol.
(2)硝基苯甲酸乙酯在OH-存在的条件下发生水解反应:
O2NC6H4COOC2H5+OH-?O2NC6H4COOO-+C2H5OH
两种反应物的初始浓度均为0.050mol•L-1,某温度下测得O2NC6H4COOC2H5的转化率α随时间变化的数据如下表所示:
| t/s | 0 | 120 | 180 | 240 | 330 | 530 | 600 | 700 | 800 |
| α/% | 0 | 33 | 42 | 49 | 59 | 73 | 74 | 75 | 75 |
②为提高O2NC6H4COOC2H5的转化率,可以采取的措施有增加OH-的浓度、移去产物. (写1条即可)
(3)2015年8月12日天津港爆炸中有一定量的氰化物泄露,可用如图2所示装置除去含CN-、Cl-废水中的CN-,控制溶液pH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,该反应的离子方程式为2CN-+5ClO-+H2O═N2↑+2CO2↑+5Cl-+2OH-,,其中两个电极的材料分别为石墨和铁,则石墨作阳极,其电极反应式为Cl-+2OH--2e-═ClO-+H2O.
20.检验溴乙烷中是否有溴元素,合理的实验方法是( )
| A. | 加入氯水后振荡,看水层里是否有棕红色的溴出现 | |
| B. | 加入硝酸银溶液,再加稀硝酸,观察有无浅黄色沉淀生成 | |
| C. | 加入NaOH水溶液共热,冷却后加硝酸银溶液,观察有无浅黄色沉淀生成 | |
| D. | 加入NaOH水溶液共热,冷却后用过量稀硝酸中和过量碱后,再加硝酸银溶液,观察有无浅黄色沉淀生成 |
7. 密闭容器中,反应2X(g)+Y(g)?2Z(g)△H=Q kJ/mol,在不同温度(T1和T2)及压强(P1和P2)下,产物Z的体积分数(φ)与反应时间(t)的关系如图所示.下列判断正确的是( )
密闭容器中,反应2X(g)+Y(g)?2Z(g)△H=Q kJ/mol,在不同温度(T1和T2)及压强(P1和P2)下,产物Z的体积分数(φ)与反应时间(t)的关系如图所示.下列判断正确的是( )
 密闭容器中,反应2X(g)+Y(g)?2Z(g)△H=Q kJ/mol,在不同温度(T1和T2)及压强(P1和P2)下,产物Z的体积分数(φ)与反应时间(t)的关系如图所示.下列判断正确的是( )
密闭容器中,反应2X(g)+Y(g)?2Z(g)△H=Q kJ/mol,在不同温度(T1和T2)及压强(P1和P2)下,产物Z的体积分数(φ)与反应时间(t)的关系如图所示.下列判断正确的是( )| A. | T1<T2,P1<P2,Q>0 | B. | T1>T2,P1>P2,Q>0 | C. | T1>T2,P1>P2,Q<0 | D. | T1<T2,P1<P2,Q<0 |
17.下列有关物质的制备或保存方法正确的是( )
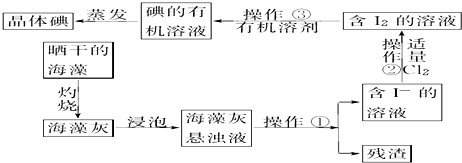
| A. | 实验室从海带提取单质碘的方法是:取样→灼烧→溶解→过滤→萃取 | |
| B. | 氢氧化钠溶液保存在玻璃塞的试剂瓶中 | |
| C. | 向氯化铝溶液滴入过量的氨水制备氢氧化铝 | |
| D. | 溴化银保存在无色玻璃瓶中 |
2.下列有关离子的检验及结论一定正确的是( )
| A. | 向某无色溶液中加入BaCl2溶液后有白色沉淀产生,再加盐酸,沉淀不消失,则原溶液一定含有SO42- | |
| B. | 向某无色溶液中加入稀盐酸后产生无色无味气体,该气体能使澄清石灰水变浑浊,则原溶液一定含有CO32- | |
| C. | 向某无色溶液中滴加新制氯水后,再滴加四氯化碳,振荡、静置、分层,若下层溶液呈紫红色,则原溶液中含有I- | |
| D. | 向某溶液中加入几滴KSCN溶液,溶液显红色,则原溶液中一定有Fe3+没有Fe2+ |




 (1)写出明矾[KAl(SO4)2•12H2O]在水中的电离方程式KAl(SO4)2•12H2O=K++Al3++2SO42-+12H2O,明矾净水的原因是因为它与水反应产生的Al(OH)3胶体具有吸附性.
(1)写出明矾[KAl(SO4)2•12H2O]在水中的电离方程式KAl(SO4)2•12H2O=K++Al3++2SO42-+12H2O,明矾净水的原因是因为它与水反应产生的Al(OH)3胶体具有吸附性.