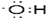题目内容
15.已知亚硫酸(H2SO3)为中强酸,某化工厂设计以下流程制备Na2SO3产品(图1).
(1)反应Ⅰ中碳酸钠溶液与二氧化硫发生反应,有关组分的质量分数变化如图2所示.
①图中曲线2、3表示的组分分别为NaHCO3、Na2SO3.(填化学式)
②图中M点之后发生反应的离子方程式为SO2+SO32-=2HSO3-.
(2)实验时,反应Ⅱ中加入NaOH溶液的目的是NaHSO3+NaOH=Na2SO3+H2O(主要);SO2+2NaOH=Na2SO3+H2O(次要);(用化学方程式表示).
(3)国家标准规定产品中Na2SO3的质量分数≥97%为优等品,≥93.0%为一等品.为了确定实验所得产品的等级,研究小组采用了以下方法进行测定:称取2.64g产品,用蒸馏水溶解,加入足量双氧水使Na2SO3完全氧化生成Na2SO4,再加入盐酸酸化的BaCl2溶液,当溶液中SO42-恰好完全沉淀,将所得沉淀进行过滤、洗涤、干燥后称量,称得质量为4.66g,则产品中Na2SO3的质量分数为95.45%.(不考虑产品中Na2SO4的影响)
分析 碳酸钠溶液中通入二氧化硫依次发生的反应为Ⅰ:2Na2CO3+SO2+H2O=2NaHCO3+Na2SO3,2NaHCO3+SO2=Na2SO3+CO2,SO2+Na2SO3=2NaHSO3,反应Ⅱ是加入氢氧化钠溶液发生反应:NaHSO3+NaOH=Na2SO3+H2O(主要),SO2+2NaOH=Na2SO3+H2O(次要),得到亚硫酸钠溶液蒸发浓缩、冷却结晶过滤洗涤得到Na2SO3.
(1)①依据反应过程和图象曲线变化可知,图象3表示的是亚硫酸钠,图象2表示的是碳酸氢钠;
②M点之后发生反应的方程式为:SO2+Na2SO3=2NaHSO3;
(2)“反应II”中加入NaOH溶液的目的是和亚硫酸氢钠反应得到亚硫酸钠;
(3)称取2.64g产品,用蒸馏水溶解,加入足量的双氧水使Na2SO3完全氧化生成Na2SO4,再加入过量的BaCl2溶液,所得沉淀经过过滤、洗涤、干燥后称量,质量为4.660g,为硫酸钡沉淀质量,反应为:Na2SO3+H2O2=Na2SO4+H2O,Na2SO4+BaCl2=2NaCl+BaSO4↓,结合硫酸钡物质的量,硫元素守恒计算.
解答 解:碳酸钠溶液中通入二氧化硫依次发生的反应为Ⅰ:2Na2CO3+SO2+H2O=2NaHCO3+Na2SO3,2NaHCO3+SO2=Na2SO3+CO2,SO2+Na2SO3=2NaHSO3,反应Ⅱ是加入氢氧化钠溶液发生反应:NaHSO3+NaOH=Na2SO3+H2O(主要),SO2+2NaOH=Na2SO3+H2O(次要),得到亚硫酸钠溶液蒸发浓缩、冷却结晶过滤洗涤得到Na2SO3.
(1)①依据反应过程和图象曲线变化可知,图象3表示的是亚硫酸钠,线2表示的组分为NaHCO3,
故答案为:NaHCO3、Na2SO3;
②图中M点之后发生反应的方程式为SO2+Na2SO3=2NaHSO3,
故答案为:SO2+SO32-=2HSO3-;
(2)“反应II”中加入NaOH溶液的目的是和亚硫酸氢钠反应得到亚硫酸钠,反应的化学方程式为:NaHSO3+NaOH=Na2SO3+H2O(主要); SO2+2NaOH=Na2SO3+H2O(次要),
故答案为:NaHSO3+NaOH=Na2SO3+H2O(主要); SO2+2NaOH=Na2SO3+H2O(次要);
(3)Na2SO3+H2O2=Na2SO4+H2O,Na2SO4+BaCl2=2NaCl+BaSO4↓
m(BaSO4)=4.660g,
n(BaSO4)=$\frac{4.66g}{233g/mol}$=0.020mol,
则经氧化后n(Na2SO4)=0.020mol,
不考虑产品中Na2SO4的影响,则n(Na2SO3)=n(BaSO4)=0.020mol,
m(Na2SO3)=0.020mol×126 g/mol=2.52g,
w(Na2SO3)=$\frac{2.52g}{2.64g}$×100%≈95.45%,
故答案为:95.45%.
点评 本题考查了无机物制备流程、反应原理及其物质组成的实验测定和含量计算应用,题目难度中等.

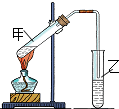
 如图为实验室制取少量乙酸乙酯的装置图.下列关于该实验的叙述中,不正确的是( )
如图为实验室制取少量乙酸乙酯的装置图.下列关于该实验的叙述中,不正确的是( )| A. | 向a试管中先加入浓硫酸,然后边摇动试管边慢慢加入乙醇,再加冰醋酸 | |
| B. | 试管b中导气管下端管口不能浸入液面的原因是防止实验过程中发生倒吸现象 | |
| C. | 实验时加热试管a的目的是及时将乙酸乙酯蒸出并加快反应速率 | |
| D. | 采用长玻璃导管有导气兼冷凝的作用 |
| t/s | 0 | t1 | t2 | t3 | t4 |
| n(SO3)/mol | 0 | 0.8 | 1.4 | 1.6 | 1.6 |
| A. | 反应在0~t1s内的平均速率v(SO2)=$\frac{0.8}{{t}_{1}}$mol•L-1•s-1 | |
| B. | 保持其他条件不变,若增大O2的浓度,到达新平衡时SO2转化率会增大 | |
| C. | 平衡时,再向容器中充入0.4mol SO2和1.6mol SO3,平衡不移动 | |
| D. | 保持温度不变,向该容器中再充入2 mol SO2、1mol O2,反应到达新平衡时$\frac{n(S{O}_{3})}{n({O}_{2})}$减小 |
| A. | $\frac{1}{2}$N2H4+$\frac{1}{2}$O2═$\frac{1}{2}$N2+H2O△H=-267 kJ•mol-1 | |
| B. | N2H4(g)+O2(g)═N2(g)+2H2O(l)△H=-133.5 kJ•mol-1 | |
| C. | N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=+534 kJ | |
| D. | N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534 kJ•mol-1 |
| A. | 在任何条件下,化学平衡常数都是一个定值 | |
| B. | 化学平衡常数K可以推断一个可逆反应进行的程度 | |
| C. | 化学平衡常数K只与温度、反应物浓度、体系的压强有关 | |
| D. | 当改变反应物的浓度时,化学平衡常数会发生改变 |
| A. | Na与水反应时增大水的用量 | |
| B. | Fe与稀硫酸反应制取H2时,改用浓硫酸 | |
| C. | 在K2SO4与BaCl2两溶液反应时,增大反应容器体积 | |
| D. | Al在氧气中燃烧生成Al2O3,将Al片改成Al粉 |
 (1)“酒是陈的香”,是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置由乙醇、乙酸和浓硫酸来制取乙酸乙酯.回答下列问题:
(1)“酒是陈的香”,是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置由乙醇、乙酸和浓硫酸来制取乙酸乙酯.回答下列问题: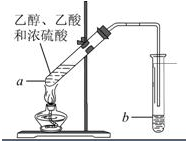 红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了有香味的酯.在实验室也可以用如图所示的装置制取乙酸乙酯,请回答下列问题.
红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了有香味的酯.在实验室也可以用如图所示的装置制取乙酸乙酯,请回答下列问题.