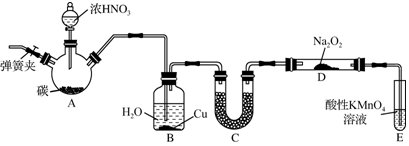
题目内容
6.一定温度时,向2.0L恒容密闭容器中充入2mol SO2和1mol O2,发生反应:2SO2(g)+O2(g)?2SO3(g).经过一段时间后达到平衡.反应过程中测定的部分数据见表:| t/s | 0 | t1 | t2 | t3 | t4 |
| n(SO3)/mol | 0 | 0.8 | 1.4 | 1.6 | 1.6 |
| A. | 反应在0~t1s内的平均速率v(SO2)=$\frac{0.8}{{t}_{1}}$mol•L-1•s-1 | |
| B. | 保持其他条件不变,若增大O2的浓度,到达新平衡时SO2转化率会增大 | |
| C. | 平衡时,再向容器中充入0.4mol SO2和1.6mol SO3,平衡不移动 | |
| D. | 保持温度不变,向该容器中再充入2 mol SO2、1mol O2,反应到达新平衡时$\frac{n(S{O}_{3})}{n({O}_{2})}$减小 |
分析 由表中数据可知t3 时达到平衡,则
2SO2(g)+O2(g)?2SO3(g)
起始(mol) 2 1 0
转化(mol) 1.6 0.8 1.6
平衡(mol) 0.4 0.2 1.6
浓度(mol/L)0.2 0.1 0.8
平衡时k=$\frac{0.{8}^{2}}{0.{2}^{2}×0.1}$=160,可解答平衡常数判断平衡移动的方向.
解答 解:由表中数据可知t3 时达到平衡,则
2SO2(g)+O2(g)?2SO3(g)
起始(mol) 2 1 0
转化(mol) 1.6 0.8 1.6
平衡(mol) 0.4 0.2 1.6
浓度(mol/L)0.2 0.1 0.8
平衡时k=$\frac{0.{8}^{2}}{0.{2}^{2}×0.1}$=160,
A.反应在0~t1s内生成0.8molSO3,的平均速率v(SO2)=$\frac{0.4}{{t}_{1}}$mol•L-1•s-1,故A错误;
B.保持其他条件不变,若增大O2的浓度,平衡正向移动,到达新平衡时SO2转化率会增大,故B正确;
C.平衡时,再向容器中充入0.4mol SO2和1.6mol SO3,则此时(SO2)=0.4mol/L,c(O2)=0.1mol/L,c(SO3)=1.6mol/L,$\frac{1.{6}^{2}}{0.{4}^{2}×0.1}$=160=k,则平衡不移动,故C正确;
D.保持温度不变,向该容器中再充入2 mol SO2、1mol O2,相当于增大压强,平衡正向移动,则新平衡时$\frac{n(S{O}_{3})}{n({O}_{2})}$增大,故D错误.
故选BC.
点评 本题考查化学平衡的计算,为高频考点,侧重于学生的分析、计算能力的考查,注意把握化学平衡常数的计算、化学平衡移动原理,注意把握平衡常数的运用,难度中等.

| A. | 混合物 | B. | 单质 | C. | 氧化物 | D. | 化合物 |
| A. | 石墨 | B. | 二氧化锰 | C. | 锌 | D. | 汞 |
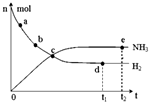 科学家一直致力于“人工固氮”的新方法研究.目前合成氨技术原理为:N2(g)+3H2(g)?2NH3(g).在673K,30MPa下,上述合成氨反应中n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )
科学家一直致力于“人工固氮”的新方法研究.目前合成氨技术原理为:N2(g)+3H2(g)?2NH3(g).在673K,30MPa下,上述合成氨反应中n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )| A. | 点a的正反应速率比点b的大 | |
| B. | 点c处反应达到化学平衡状态 | |
| C. | 点d和点e处的n(N2)不相同 | |
| D. | 点e反应达到化学平衡状态,反应停止 |
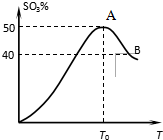 在体积为2L密闭 绝热容器中,将物质的量均为2.00mol的SO2、O2混合,发生如下反应:2SO2(g)+O2(g)?2SO3(g),容器中SO3的体积分数
在体积为2L密闭 绝热容器中,将物质的量均为2.00mol的SO2、O2混合,发生如下反应:2SO2(g)+O2(g)?2SO3(g),容器中SO3的体积分数