题目内容
16.下列实验方案中不能达到相应实验目的是( )| A | B | C | D | |
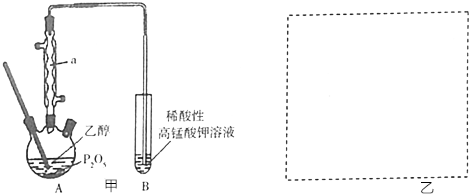
| 方案 | 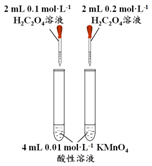 | 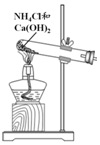 | 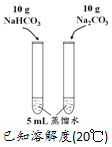 NaHCO3:9.6 g Na2CO3:21.8 g | 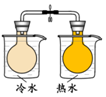 将NO2球浸泡在冷水和热水中 |
| 目的 | 探究浓度对化学反应速率的影响 | 制备氨气 | 室温下比较NaHCO3和Na2CO3的溶解度 | 探究温度对化学平衡的影响 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.只有亚硫酸钠的浓度一个变量;
B.实验室中用氯化铵和氢氧化钙固体加热制备氨气,图示装置合理;
C.根据溶解度数据可知,两个试管中得到的都是饱和溶液,无法比较二者溶解度大小;
D.只有温度一个变量,由图可知,温度高颜色深.
解答 解:A.只有亚硫酸钠的浓度一个变量,图中装置可探究浓度对反应速率影响,故A正确;
B.氯化铵和氢氧化钙固体加热可制备氨气,图示装置合理,能够达到实验目的,故B正确;
C.5mL蒸馏水的质量约为5g,根据碳酸钠、碳酸氢钠的溶解度可知,10g碳酸钠、碳酸氢钠在5mL水中都形成了饱和溶液,无法判断二者溶解度大小,故C错误;
D.只有温度一个变量,由图可知,温度高颜色深,则图中装置可探究温度对化学平衡的影响,故D正确;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,涉及反应速率及平衡的影响因素、溶解度大小比较、气体制备等,把握反应原理、实验基本技能为解答的关键,注意实验装置的作用,侧重实验评价分析的考查,题目难度不大.

练习册系列答案
 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案
相关题目
6.2molA与2mol混合于2L的密闭容器中,发生反应::2A(g)+3B(g)?2C(g)+zD(g),2s后A的转化率为50%,测得v(D)=0.25mol•L-1•s-1,下列推断正确的是( )
| A. | v(C)=0.2mol•L-1•s-1 | B. | z=3 | ||
| C. | B的转化率为25% | D. | C平衡时的浓度为0.5mol•L-1 |
7.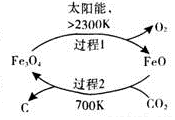 二氧化碳的回收利用是环保领域研究热点.
二氧化碳的回收利用是环保领域研究热点.
(1)在太阳能的作用下,以CO2为原料制取炭黑的流程如图1所示.总反应的化学方程式为CO2$\frac{\underline{\;太阳能\;}}{FeO}$C+O2.
(2)有一种用CO2生产甲醇燃料的方法:CO2+3H2?CH3OH+H2O.已知298K和101KPa条件下:
CO2(g)+3H2(g)?CH3OH(g)+H2O(l)△H=-a kJ•mol-1;
2H2(g)+O2(g)=2H2O(l)△H=-b kJ•mol-1;
CH3OH(g)=CH3OH(l)△H=-c kJ•mol-1,
则CH3OH(l)的标准燃烧热△H=a+c-1.5b kJ•mol-1.
(3)CO2经过催化氢化合成低碳烯烃,合成乙烯反应为2CO2(g)+6H2(g)?CH2=CH2(g)+4H2O(g)△H<0在恒容密闭容器中充入2mol CO2和n mol H2,在一定条件下发生反应,CO2的转化率与温度、投料比X=[$\frac{n({H}_{2})}{n(C{O}_{2})}$]的关系如图1所示.

①平衡常数KA>KB
②T K时,某密闭容器发生上述反应,反应进行到不同时间测得各物质的浓度如表:
20~30min间只改变了某一条件,根据上表中的数据判断改变的条件可能是D
A.通入一定量H2 B.通入一定量CH2=CH2C.加入合适催化剂 D.缩小容器体积
在图2中画出CH2=CH2的浓度随反应时间的变化
(4)在催化剂M的作用下,CO2和H2同时发生下列两个反应
A.2CO2(g)+6H2(g)?CH2=CH2(g)+4H2O(g)△H<0
B.2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)△H<0
图3是乙烯在相同时间内,不同温度下的产率,则高于460℃时乙烯产率降低的原因不可能是BD
A.催化剂M的活性降低 B.A反应的平衡常数变大
C.生成甲醚的量增加 D.B反应的活化能增大
(5)Na2CO3溶液也通常用来捕获CO2.常温下,H2CO3的第一步、第二步电离常数分别约为Ka1=4×10-7,Ka2=5×10-11,则0.5mol•L-1的Na2CO3溶液的pH等于12(不考虑第二步水解和H2O的电离)
 二氧化碳的回收利用是环保领域研究热点.
二氧化碳的回收利用是环保领域研究热点.(1)在太阳能的作用下,以CO2为原料制取炭黑的流程如图1所示.总反应的化学方程式为CO2$\frac{\underline{\;太阳能\;}}{FeO}$C+O2.
(2)有一种用CO2生产甲醇燃料的方法:CO2+3H2?CH3OH+H2O.已知298K和101KPa条件下:
CO2(g)+3H2(g)?CH3OH(g)+H2O(l)△H=-a kJ•mol-1;
2H2(g)+O2(g)=2H2O(l)△H=-b kJ•mol-1;
CH3OH(g)=CH3OH(l)△H=-c kJ•mol-1,
则CH3OH(l)的标准燃烧热△H=a+c-1.5b kJ•mol-1.
(3)CO2经过催化氢化合成低碳烯烃,合成乙烯反应为2CO2(g)+6H2(g)?CH2=CH2(g)+4H2O(g)△H<0在恒容密闭容器中充入2mol CO2和n mol H2,在一定条件下发生反应,CO2的转化率与温度、投料比X=[$\frac{n({H}_{2})}{n(C{O}_{2})}$]的关系如图1所示.

①平衡常数KA>KB
②T K时,某密闭容器发生上述反应,反应进行到不同时间测得各物质的浓度如表:
| 时间(min) 浓度(mol•L-1) | 0 | 10 | 20 | 30 | 40 | 50 |
| H2(g) | 6.00 | 5.40 | 5.10 | 9.00 | 8.40 | 8.40 |
| CO2(g) | 2.00 | 1.80 | 1.70 | 3.00 | 2.80 | 2.80 |
| CH2=CH2(g) | 0 | 0.10 | 0.15 | 3.20 | 3.30 | 3.30 |
A.通入一定量H2 B.通入一定量CH2=CH2C.加入合适催化剂 D.缩小容器体积
在图2中画出CH2=CH2的浓度随反应时间的变化
(4)在催化剂M的作用下,CO2和H2同时发生下列两个反应
A.2CO2(g)+6H2(g)?CH2=CH2(g)+4H2O(g)△H<0
B.2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)△H<0
图3是乙烯在相同时间内,不同温度下的产率,则高于460℃时乙烯产率降低的原因不可能是BD
A.催化剂M的活性降低 B.A反应的平衡常数变大
C.生成甲醚的量增加 D.B反应的活化能增大
(5)Na2CO3溶液也通常用来捕获CO2.常温下,H2CO3的第一步、第二步电离常数分别约为Ka1=4×10-7,Ka2=5×10-11,则0.5mol•L-1的Na2CO3溶液的pH等于12(不考虑第二步水解和H2O的电离)
4.以下电离方程式错误的是( )
| A. | NaHCO3=Na++H++CO32- | B. | Fe2(SO4)3=2Fe3++3SO42- | ||
| C. | MgCl2=Mg2++2Cl- | D. | NaOH=Na++OH- |
1.某研究性学习小组为了研究影响化学反应速率的因素,设计如下方案:
已知:反应的方程式(未配平):KMnO4+H2C2O4+H2SO4→K2SO4+MnSO4+CO2↑+H2O
(1)实验记时方法是从溶液混合开始记时,至紫红色刚好褪去时记时结束.
(2)实验I和Ⅱ研究浓度对反应速率的影响,实验Ⅰ和Ⅲ研究温度对反应速率的影响.则v2=1,v3=2,v5=0.
(3)请配平上面的化学方程式:
2KMnO4+5H2C2O4+3H2SO4=1K2SO4+2MnSO4+10CO2↑+8H2O.
(4)某小组在进行每组实验时,均发现该反应所示开始很慢,突然就加快,其可能的原因是MnSO4是反应产物,开始浓度小,影响不大,随着反应进行,浓度增大,催化效果明显.
(5)实验结束后,读数前为了使两个量气管的压强相等,避免产生压强差,影响测定结果,需要进行的操作是移动量气管,使两个量气管的液面相平.
| 实验 编号 | 0.01mol•L-1 酸性KMnO4溶液 | 0.1mol•L-1 H2C2O4溶液 | 水 | 1mol•L-1 MnSO4溶液 | 反应温度 /℃ | 反应时间 |
| Ⅰ | 2mL | 2mL | 0 | 0 | 20 | 125 |
| Ⅱ | v1mL | v2mL | 1mL | 0 | 20 | 320 |
| Ⅲ | v3mL | v4mL | v5mL | 0 | 50 | 30 |
| Ⅳ | 2mL | 2mL | 0 | 2滴 | 20 | 10 |
(1)实验记时方法是从溶液混合开始记时,至紫红色刚好褪去时记时结束.
(2)实验I和Ⅱ研究浓度对反应速率的影响,实验Ⅰ和Ⅲ研究温度对反应速率的影响.则v2=1,v3=2,v5=0.
(3)请配平上面的化学方程式:
2KMnO4+5H2C2O4+3H2SO4=1K2SO4+2MnSO4+10CO2↑+8H2O.
(4)某小组在进行每组实验时,均发现该反应所示开始很慢,突然就加快,其可能的原因是MnSO4是反应产物,开始浓度小,影响不大,随着反应进行,浓度增大,催化效果明显.
(5)实验结束后,读数前为了使两个量气管的压强相等,避免产生压强差,影响测定结果,需要进行的操作是移动量气管,使两个量气管的液面相平.
8.下列说法不正确的是( )
| A. | 中和反应的反应热测定需用温度计测量温度二次,分别为反应的起始温度和最高温度 | |
| B. | 用试纸检验气体时,可先把试纸用蒸馏水润湿,粘在玻璃棒一端,用玻璃棒把试纸放到盛待测气体的容器口附近 | |
| C. | 用剩的药品能否放回原瓶,应视具体情况而定 | |
| D. | 将铂丝放在盐酸中洗涤并灼烧为无色后,再蘸取待测物进行焰色反应 |
5.下列实验操作正确的是( )
| 实验 | 操作 | |
| A | 证明某溶液中存在Fe2+ | 先加少量氯水,再滴加KSCN溶液,出现血红色 |
| B | 测定熔融苛性钠的导电性 | 在瓷坩埚中熔化氢氧化钠固体后进行测量 |
| C | 证明氯的非金属性大于碳 | 向碳酸钙中滴加盐酸,有气泡产生 |
| D | 制备氯化镁晶体 | 将MgCl2溶液在氯化氢的气流中蒸干 |
| A. | A | B. | B | C. | C | D. | D |




 .
.