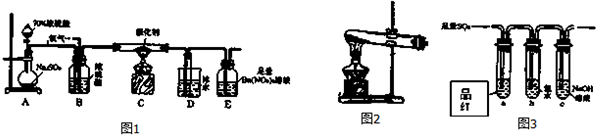
题目内容
19.下列文字表述与反应方程式对应且正确的是( )| A. | 过氧化钠和水反应:2O22-+2H2O=4OH-+O2↑ | |
| B. | 含等物质的量的KHCO3和Ba(OH)2溶液混合:HCO3-+Ba2++OH-═BaCO3↓+H2O | |
| C. | 向氯化铝溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| D. | 硫化钠水溶液呈碱性:S2-+H2O?HS-+OH- |
分析 A.过氧化钠固体与水反应,过氧化钠是氧化物,用化学式;
B.等体积等物质的量浓度的NaHCO3溶液与Ba(OH)2溶液混合,氢氧化钡过量,反应生成碳酸钡沉淀、氢氧化钠和水;
C.氢氧化铝沉淀不溶于氨水;
D.硫离子的水解分步进行,主要以第一步为主,其水解的离子方程式写出第一步水解即可.
解答 解:A.过氧化钠固体与水反应,过氧化钠是氧化物,用化学式,正确的离子方程式为2Na2O2+2H2O═4OH?+O2↑+4Na+,故A错误;
B.NaHCO3和Ba(OH)2的物质的量相等,氢氧化钡过量,反应生成碳酸钡、氢氧化钠和水,反应的离子方程式为:HCO3-+Ba2++OH-=BaCO3↓+H2O,故B正确;
C.向氯化铝溶液中加入过量氨水生成氢氧化铝沉淀,其反应离子方程式为:Al3++3NH3•H2O═Al(OH)3↓+3NH4+,故C错误;
D.硫化钠中的硫离子是多元弱酸根离子,分步水解,以第一步为主,其水解离子方程式为:S2-+H2O?HS-+OH-,故D正确;
故选BD.
点评 本题考查了离子方程式的书写判断,题目难度不大,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
9.加热N2O5依次发生的分解反应为:①N2O5?N2O3+O2,②N2O3?N2O+O2;在2L密闭容器中充入8mol N2O5,加热到t℃,达到平衡状态后O2为9mol,N2O3为3.4mol,则t℃时反应①的平衡常数为( )
| A. | 10.7 mol/L | B. | 8.5 mol/L | C. | 9.6 mol/L | D. | 10.2 mol/L |
7.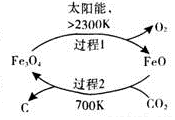 二氧化碳的回收利用是环保领域研究热点.
二氧化碳的回收利用是环保领域研究热点.
(1)在太阳能的作用下,以CO2为原料制取炭黑的流程如图1所示.总反应的化学方程式为CO2$\frac{\underline{\;太阳能\;}}{FeO}$C+O2.
(2)有一种用CO2生产甲醇燃料的方法:CO2+3H2?CH3OH+H2O.已知298K和101KPa条件下:
CO2(g)+3H2(g)?CH3OH(g)+H2O(l)△H=-a kJ•mol-1;
2H2(g)+O2(g)=2H2O(l)△H=-b kJ•mol-1;
CH3OH(g)=CH3OH(l)△H=-c kJ•mol-1,
则CH3OH(l)的标准燃烧热△H=a+c-1.5b kJ•mol-1.
(3)CO2经过催化氢化合成低碳烯烃,合成乙烯反应为2CO2(g)+6H2(g)?CH2=CH2(g)+4H2O(g)△H<0在恒容密闭容器中充入2mol CO2和n mol H2,在一定条件下发生反应,CO2的转化率与温度、投料比X=[$\frac{n({H}_{2})}{n(C{O}_{2})}$]的关系如图1所示.

①平衡常数KA>KB
②T K时,某密闭容器发生上述反应,反应进行到不同时间测得各物质的浓度如表:
20~30min间只改变了某一条件,根据上表中的数据判断改变的条件可能是D
A.通入一定量H2 B.通入一定量CH2=CH2C.加入合适催化剂 D.缩小容器体积
在图2中画出CH2=CH2的浓度随反应时间的变化
(4)在催化剂M的作用下,CO2和H2同时发生下列两个反应
A.2CO2(g)+6H2(g)?CH2=CH2(g)+4H2O(g)△H<0
B.2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)△H<0
图3是乙烯在相同时间内,不同温度下的产率,则高于460℃时乙烯产率降低的原因不可能是BD
A.催化剂M的活性降低 B.A反应的平衡常数变大
C.生成甲醚的量增加 D.B反应的活化能增大
(5)Na2CO3溶液也通常用来捕获CO2.常温下,H2CO3的第一步、第二步电离常数分别约为Ka1=4×10-7,Ka2=5×10-11,则0.5mol•L-1的Na2CO3溶液的pH等于12(不考虑第二步水解和H2O的电离)
 二氧化碳的回收利用是环保领域研究热点.
二氧化碳的回收利用是环保领域研究热点.(1)在太阳能的作用下,以CO2为原料制取炭黑的流程如图1所示.总反应的化学方程式为CO2$\frac{\underline{\;太阳能\;}}{FeO}$C+O2.
(2)有一种用CO2生产甲醇燃料的方法:CO2+3H2?CH3OH+H2O.已知298K和101KPa条件下:
CO2(g)+3H2(g)?CH3OH(g)+H2O(l)△H=-a kJ•mol-1;
2H2(g)+O2(g)=2H2O(l)△H=-b kJ•mol-1;
CH3OH(g)=CH3OH(l)△H=-c kJ•mol-1,
则CH3OH(l)的标准燃烧热△H=a+c-1.5b kJ•mol-1.
(3)CO2经过催化氢化合成低碳烯烃,合成乙烯反应为2CO2(g)+6H2(g)?CH2=CH2(g)+4H2O(g)△H<0在恒容密闭容器中充入2mol CO2和n mol H2,在一定条件下发生反应,CO2的转化率与温度、投料比X=[$\frac{n({H}_{2})}{n(C{O}_{2})}$]的关系如图1所示.

①平衡常数KA>KB
②T K时,某密闭容器发生上述反应,反应进行到不同时间测得各物质的浓度如表:
| 时间(min) 浓度(mol•L-1) | 0 | 10 | 20 | 30 | 40 | 50 |
| H2(g) | 6.00 | 5.40 | 5.10 | 9.00 | 8.40 | 8.40 |
| CO2(g) | 2.00 | 1.80 | 1.70 | 3.00 | 2.80 | 2.80 |
| CH2=CH2(g) | 0 | 0.10 | 0.15 | 3.20 | 3.30 | 3.30 |
A.通入一定量H2 B.通入一定量CH2=CH2C.加入合适催化剂 D.缩小容器体积
在图2中画出CH2=CH2的浓度随反应时间的变化
(4)在催化剂M的作用下,CO2和H2同时发生下列两个反应
A.2CO2(g)+6H2(g)?CH2=CH2(g)+4H2O(g)△H<0
B.2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)△H<0
图3是乙烯在相同时间内,不同温度下的产率,则高于460℃时乙烯产率降低的原因不可能是BD
A.催化剂M的活性降低 B.A反应的平衡常数变大
C.生成甲醚的量增加 D.B反应的活化能增大
(5)Na2CO3溶液也通常用来捕获CO2.常温下,H2CO3的第一步、第二步电离常数分别约为Ka1=4×10-7,Ka2=5×10-11,则0.5mol•L-1的Na2CO3溶液的pH等于12(不考虑第二步水解和H2O的电离)
4.以下电离方程式错误的是( )
| A. | NaHCO3=Na++H++CO32- | B. | Fe2(SO4)3=2Fe3++3SO42- | ||
| C. | MgCl2=Mg2++2Cl- | D. | NaOH=Na++OH- |
8.下列说法不正确的是( )
| A. | 中和反应的反应热测定需用温度计测量温度二次,分别为反应的起始温度和最高温度 | |
| B. | 用试纸检验气体时,可先把试纸用蒸馏水润湿,粘在玻璃棒一端,用玻璃棒把试纸放到盛待测气体的容器口附近 | |
| C. | 用剩的药品能否放回原瓶,应视具体情况而定 | |
| D. | 将铂丝放在盐酸中洗涤并灼烧为无色后,再蘸取待测物进行焰色反应 |
19.一定温度时,向容积为2L的密闭容器中充入一定量的SO2和O2,发生反应:2SO2(g)+O2(g)?2SO3(g).反应过程中测定的部分数据见下表(表中t1<t2),下列说法正确的是( )
| 反应时间/min | n(SO2)/mol | n(O2)/mol |
| 0 | 0.10 | 0.060 |
| t1 | 0.012 | |
| t2 | 0.016 |
| A. | 反应在0~t1 min内的平均速率为v(SO3)=0.088/t1 mol•L-1•min-1 | |
| B. | 保持其他条件不变,起始时向容器中充入0.10molSO3和0.010 molO2,到达平衡时,n(SO2)=0.012 mol | |
| C. | 保持其他条件不变,升高温度,平衡时c(SO2)=0.0070mol•L-1,则反应的△H>0 | |
| D. | 相同温度下,起始时向容器中充入0.050molSO2和0.030molO2,达到平衡时SO2转化率大于88% |