题目内容
19.一块已被部分氧化为Na2O的钠块10.8g,将其投入一定量水中,最终得到含16g溶质的NaOH溶液,则原固体中氧化钠的质量是( )| A. | 8.5 g | B. | 10.8 g | C. | 6.2 g | D. | 4.6 g |
分析 设出钠块中钠、氧化钠的物质的量,分别根据总质量、钠元素守恒列式计算出氧化钠的物质的量,最后m=nM计算出氧化钠的质量.
解答 解:NaOH溶液中含有NaOH的物质的量为$\frac{16g}{40g/mol}$=0.4mol,
设该钠块中含有钠、氧化钠的物质的量分别为x mol、y mol,则
$\left\{\begin{array}{l}{23x+62y=10.8}\\{x+2y=0.4}\end{array}\right.$
解得:x=0.2、y=0.1,
则原固体中氧化钠的质量为:62g/mol×0.1mol=6.2g,
故选C.
点评 本题考查了混合物反应的计算,注意掌握质量守恒定律在化学计算中的应用方法,是对学生基础知识的巩固.

练习册系列答案
 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案
相关题目
9.下列解释事实的方程式不正确的是( )
| A. | 向饱和CaCl2溶液中通入少量的CO2:Ca2++CO2+H2O═CaCO3↓+2H+ | |
| B. | 用Fe2(SO4)3做净水剂:Fe3++3H2O?Fe(OH)3(胶体)+3H+ | |
| C. | 水垢中的CaSO4用Na2CO3溶液处理:CaSO4+CO32-═CaCO3+SO42- | |
| D. | 向5 mL 0.1 mol•L-1的K2Cr2O7溶液中滴加5滴浓硫酸,溶液橙色变深:Cr2O72-(橙色)+H2O?2CrO42-(黄色)+2H+ |
10.下列分离方法不合理的是( )
| A. | 从石油中得到各成分,可用蒸馏的方法,蒸馏为物理方法 | |
| B. | 提取溴水中的溴,可用加入乙醇萃取的方法 | |
| C. | 只含有泥沙的粗盐,可通过溶解、过滤、结晶的方法提纯 | |
| D. | 储存FeCl2溶液,需向试剂瓶中加入一定量的铁屑 |
7.若20g密度为ρg•cm-3的硝酸钙溶液里含1g Ca2+,则NO3-的物质的量浓度是( )
| A. | ρ400mol•L-1 | B. | 20ρmol•L-1 | C. | 2.5ρmol•L-1 | D. | 1.25ρmol•L-1 |
14.下列说法正确的是( )
| A. | Fe在一定条件下与水反应生成H2和Fe(OH)3 | |
| B. | Fe3O4溶于盐酸后加入几滴KSCN溶液,溶液不显血红色 | |
| C. | FeCl2溶液蒸干后得到的是Fe(OH)3固体 | |
| D. | 将FeCl3饱和溶液滴入NaOH溶液中可制备Fe(OH)3胶体 |
4.将浓度为0.1mol/LHF溶液加水不断稀释,下列各量始终保持增大的是( )
| A. | c(H+) | B. | Ka(HF) | C. | c(HF) | D. | C(OH-) |
11.如图电解质溶液为稀硫酸,下列说法正确的是( )
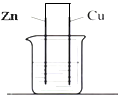

| A. | 该装置中Zn作为正极 | B. | 该装置可以实现电能转化为化学能 | ||
| C. | 电子从锌电极经过溶液到铜电极 | D. | 溶液中的H+移向铜电极 |
 W、X、Y、Z 是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10,X和Ne的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的吸引电子的能力在同周期主族元素中最大.
W、X、Y、Z 是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10,X和Ne的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的吸引电子的能力在同周期主族元素中最大.