题目内容
18.已知一定质量的二氧化锰与足量的浓盐酸反应生成的氯气为0.15mol:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.求二氧化锰的质量.分析 据方程式计算参加反应的二氧化锰的物质的量,再根据m=nM计算参加反应的二氧化锰的质量.
解答 解:令参加反应的二氧化锰的物质的量为n,则:
MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ MnCl2+Cl2↑+2H2O
1mol 1mol
n 0.15mol
解得;n=0.15mol
故参加反应的二氧化锰的质量为0.15mol×87g/mol=13.05g,
答:参加反应的二氧化锰的质量为13.05g.
点评 本题考查根据方程式的计算,比较基础,注意掌握根据方程式的计算格式,准确列出已知量与未知量的关系是解题的关键.

练习册系列答案
相关题目
8.某溶液中可能含有Na+、Mg2+、Fe2+、H+、OH-、NO3-等几种离子中的若干种,向该溶液中加入氧化铝后,溶液中有X离子生成,下列判断中正确的是( )
| A. | 溶液中可以同时含有Fe2+、NO3- | B. | 溶液中一定有OH-、Na+ | ||
| C. | 溶液中可能含有Na+、H+、Mg2+、NO3- | D. | 若X是AlO2-,则上述离子最多有2种 |
6.向一定量的Fe、FeO和Fe2O3的混合物中,加入120mL 4mol•L-1的稀硝酸,恰好使混合物完全溶解,放出1.344L(标准状况)气体,往所得溶液中加入KMnO4的酸性溶液,无明显现象,若用足量的H2在加热条件下还原相同质量的混合物,最终得到铁的物质的量为( )
| A. | 0.21mol | B. | 0.14mol | C. | 0.16mol | D. | 0.24mol |
13.下列关于1mo1•L-1的BaCl2溶液的叙述中.正确的是( )
| A. | 该溶液中C1-浓度为2mo1•L-1 | |
| B. | 该溶液中Ba2+的物质的量是1mo1 | |
| C. | 可使用250mL容量瓶分两次完成490mL该浓度的BaCl2溶液的配制 | |
| D. | 将208gBaCl2固体溶解在1L水中,形成的溶液的浓度为1mo1•L-1 |
3.设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 在相同温度下,pH=1且体积为1L的硫酸溶液所含的H+数与pH=13且体积为1L的氢氧化钠溶液所含的OH-数一定均为0.1NA | |
| B. | 7.8gNa2S和Na2O2的混合物中所含离子数为0.3NA | |
| C. | 在反应KClO4+8HCl=KCl+4Cl2↑+4H2O中,每生成4molCl2,转移的电子数为8NA | |
| D. | 在标准状况下,2.24LHF中含有的电子数为NA |
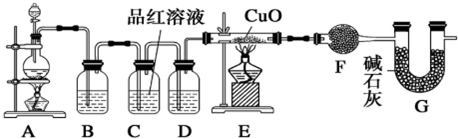
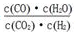 。恒容时,温度升高,H2浓度减小,下列说法正确的是
。恒容时,温度升高,H2浓度减小,下列说法正确的是 CO2+H2
CO2+H2