题目内容
9.化学小组同学依据化学反应 Zn+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ZnSO4+SO2↑+2H2O 制取 22.4L(标准状况)SO2气体.取 65.0g 锌粒与 98%的浓 H2SO4(ρ=1.84g•cm-3)110mL 充分反应,锌全部溶解.对于制得的气体,有同学认为可能混有氢气.为此,化学小组的同学设计了如下实验装置,对所制取的气体进行探究. (F 中为无水硫酸铜)
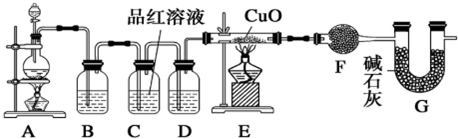
请回答下列问题:
(1)装置 A 中添加液体的仪器名称为分液漏斗;D 中的溶液为浓硫酸;
(2)请写出产生氢气的反应的离子方程式Zn+2H+═Zn2++H2↑;
(3)①装置 B 是为了吸收 SO2,则不能选用下列试剂中的B(填序号):
A.NaOH 溶液B.浓 H2SO4C.KMnO4溶液D.Na2SO3溶液
②可证实一定量的锌粒和一定量的浓硫酸反应后生成的气体中混有氢气的实验现象是装置E中黑色粉末变红色,F中无水硫酸铜变蓝色 则G的作用为防止空气中H2O进入干燥管而影响杂质气体的检验.
分析 A是制取气体的装置,制备的气体中有二氧化硫、氢气、水蒸汽,B装置是除去二氧化硫,可以用氢氧化钠等碱液吸收;C装置是检验二氧化硫是否除尽,D装置是浓硫酸,吸水干燥作用;E装置是用还原性气体还原氧化铜,F装置无水硫酸铜,检验是否有水生成;G是防止空气中H2O进入干燥管而影响杂质气体的检验,
(1)该仪器名称是分液漏斗;装置D中为浓硫酸干燥气体的作用;
(2)锌和稀硫酸反应生成硫酸锌和氢气;
(3)①二氧化硫属于酸性氧化物,能被碱液吸收;具有还原性,能被强氧化性溶液吸收;
②氢气具有还原性,能还原氧化铜,且生成水,水能使无水硫酸铜变蓝色,F中为硫酸铜,G是防止空气中水蒸气进入装置F运行现象观察.
解答 解:(1)该仪器名称是分液漏斗,D装置是浓硫酸,吸水干燥作用,
故答案为:分液漏斗;浓硫酸;
(2)随着硫酸浓度降低,锌和稀硫酸反应生成硫酸锌和氢气,离子方程式为Zn+2H+═Zn2++H2↑,故答案为:Zn+2H+═Zn2++H2↑;
(3)①二氧化硫属于酸性氧化物,能被碱液吸收;具有还原性,能被强氧化性溶液吸收,氢氧化钠溶液呈碱性,高锰酸钾溶液具有强氧化性,所以可以用氢氧化钠溶液和高锰酸钾溶液吸收二氧化硫,故选B,
故答案为:B;
②氢气具有还原性,能将黑色的CuO还原为红色的Cu,且生成水,水能使无水硫酸铜变蓝色,所以如果有氢气,看到的现象是:装置E中黑色粉末变红色,F中无水硫酸铜变蓝色,G的作用是防止空气中H2O进入干燥管而影响杂质气体的检验.;
故答案为:防止空气中H2O进入干燥管而影响杂质气体的检验.
点评 本题考查了探究实验,明确实验原理是解本题关键,根据物质的性质来分析解答,注意二氧化硫的漂白性,题目难度中等.

练习册系列答案
相关题目
20.反应4NH3(g)+5O2(g)?4NO(g)+6H2O(g)在10L密闭容器中进行,半分钟后,水蒸气的物质的量加了0.45mol,则此反应的平均速率v(X)(反应物的消耗速率或产物的生成速率)可表示为( )
| A. | v(NO)=0.0010mol•L-1•s-1 | B. | v(O2)=0.0010mol•L-1•s-1 | ||
| C. | v(NH3)=0.0100mol•L-1•s-1 | D. | v(H2O)=0.045mol•L-1•s-1 |
17.NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 1.8gD2O 分子中含有的质子数为 NA | |
| B. | 常温下,7.8gNa2O2中含有的阴离子个数为 0.1NA | |
| C. | 标准状况下,11.2L 18O2中所含中子数为 8NA | |
| D. | 25℃时,2.24 LCO2分子中共用电子对数目为 0.4NA |
4.金刚石和石墨是碳元素的两种结构不同的单质(同素异形体).在 100kPa 时,含 1mol 碳原子的石墨转化为金刚石,要吸收 1.895kJ 的热量.据此试判断下列结论正确的是( )
| A. | 金刚石比石墨稳定 | |
| B. | 石墨比金刚石稳定 | |
| C. | 含 1mol 碳原子的石墨比含 1mol 碳原子的金刚石总能量高 | |
| D. | 石墨和金刚石互为同位素 |
14.如图是冰部分结构图,下列有关说法正确的是( )


| A. | 因水分子间存在氢键,所以水加热到很高的温度都难以分解 | |
| B. | 1mol 冰中最多含有 4×6.02×1023个氢键,水分子间的氢键可表示为 O-H…O | |
| C. | 在“H2O(s)→H2O(l)→H2+O2”的变化过程中,被破坏的主要作用依次是氢键、极性键 | |
| D. | 等质量的水和冰,因水结冰后氢键数目变少,所以冰的密度比水小 |
1.下列有关说法正确的是( )
| A. | 因为 H-F 的键能大于 H-Cl,所以 HF 沸点高于 HCl | |
| B. | SO3是由极性键构成的非极性分子 | |
| C. | 氯化钠和氯化铯晶体中氯离子的配位数相同 | |
| D. | 第一电离能大小比较 Br>Se>As |
