题目内容
6.计算配制0.2mol/L NaOH溶液500mL,需要称取固体NaOH的质量是多少?分析 先根据n=cV计算出该氢氧化钠溶液中的溶质的物质的量,然后根据m=nM计算出需要氢氧化钠的质量.
解答 解:配制的0.2mol/L NaOH溶液500mL,该溶液中含有NaOH的物质的量为:0.2mol/L×0.5L=0.1mol,
需要固体NaOH的质量为:40g/mol×0.1mol=4.0g,
答:需要称取固体NaOH的质量是4.0g.
点评 本题考查了物质的量的计算,题目难度不大,明确物质的量与摩尔质量、物质的量浓度之间的关系为解答关键,试题侧重基础知识的考查,培养了学生灵活应用基础知识的能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
14.将甲烷设计成燃料电池,其利用率更高,如图所示(A,B为多孔性碳棒).持续通入甲烷,在标准状况下,消耗甲烷体积VL,则下列说法错误的是( )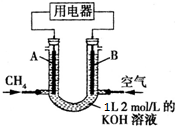

| A. | 通入CH4的一端为原电池的负极,溶液中OH-向负极区移动 | |
| B. | 当0<V≤22.4L时,电池总反应式为CH4+2O2+2KOH═K2CO3+3H2O | |
| C. | 当22.4L<V≤44.8L时,负极电极反应为CH4-8e-+9CO32-+3H2O═10HCO3- | |
| D. | 当V=33.6L时,溶液中阴离子浓度大小关系为c(CO32- )>c(HCO3-)>c(OH-) |
1.已知:H+(aq)+OH-(aq)═H2O(l);△H=-57.3kJ•mol-1.现将一定量的稀盐酸、浓硫酸、稀醋酸分别和1L 1mol•L-1的NaOH溶液恰好完全反应,其反应热分别为△H1、△H2、△H3,则△H1、△H2和△H3的大小关系为( )
| A. | △H1=△H2>△H3 | B. | △H3>△H1>△H2 | C. | △H3>△H2>△H1 | D. | △H2>△H1>△H3 |
11.下列化合物中,不能通过单质之间的反应直接制取的是( )
| A. | CuS | B. | FeCl3 | C. | SO2 | D. | Fe3O4 |
15.下列说法中错误的是( )
| A. | 石油含有C5~C11的烷烃,可通过分馏得到汽油 | |
| B. | 含C18以上的烷烃经过催化裂化可以得到汽油 | |
| C. | 天然气的主要成分是甲烷,开采天然气应做到安全规范的操作 | |
| D. | 煤中含有苯及苯的同系物,可用分馏的方法把它们分离出来 |
 ;
; ;
; ;
;