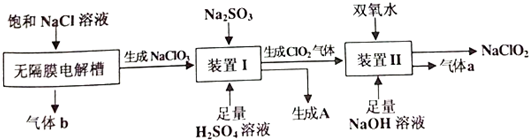
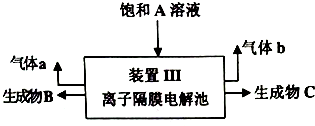
题目内容
3.某同学想通过下图装置(夹持装置已略去)实验,探究SO2与Na2O2反应的产物.Ⅰ.装置B的作用吸收水,干燥SO2气体.
装置D除了有防止空气中的水蒸气和二氧化碳进入C装置与Na2O2反应作用外,还可以吸收二氧化硫尾气,防止污染.

Ⅱ.对C中固体产物提出如下假设:
假设1:只有Na2SO3
假设2:只有Na2SO4
假设3:Na2SO3和Na2SO4都有
假设2的反应方程式为Na2O2+SO2=Na2SO4.
分析 Ⅰ.装置B的作用是吸收水,干燥SO2气体,装置D除了吸收过量的SO2,避免污染空气外,还起到的作用是防止空气中的水蒸气和二氧化碳进入C装置与Na2O2反应;
Ⅱ.根据假设1和假设3分析,二氧化硫与过氧化钠反应可能生成的物质解答;
若只有Na2SO4生成,二氧化硫被过氧化钠氧化为硫酸钠.
解答 解:Ⅰ.水能和过氧化钠反应生成氢氧化钠和氧气,反应离子方程式为2Na2O2+2H2O=4Na++4OH-+O2↑;
装置D除了吸收过量的SO2,避免污染空气外,还起到的作用是防止空气中的水蒸气和二氧化碳进入C装置与Na2O2反应;
故答案为:吸收水,干燥SO2气体;吸收二氧化硫尾气,防止污染;
Ⅱ.假设2:由假设1与假设3可知,固体只有Na2SO4,若只有Na2SO4生成,二氧化硫被过氧化钠氧化为硫酸钠,反应方程式为Na2O2+SO2=Na2SO4,
故答案为:Na2SO4;Na2O2+SO2=Na2SO4 .
点评 本题考查学生对实验原理与装置的理解、物质组成的测定等、实验方案设计等,难度中等,理解原理是关键,需要学生具有扎实的基础知识与综合运用知识分析解决问题的能力,难度中等.

练习册系列答案
相关题目
3.A、B、C、D、E五种短周期主族元素,它们的原子序数依次增大.已知:A和C、B和D分别位于同主族,且B、D质子数之和是A、C质子数之和的2倍.下列说法正确的是( )
| A. | 原子半径的大小顺序:r(B)>r(C)>r(D) | |
| B. | C的最高价氧化物对应水化物的碱性在同周期中最强 | |
| C. | E分别与A、C形成的化合物中化学键类型相同 | |
| D. | B的简单气态氢化物的热稳定性比D的弱 |
8.短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示.已知Y、W的原子序数之和是Z的3倍,下列说法正确的是( )
| Y | Z | ||
| X | W |
| A. | 原子半径:X<Y<Z | |
| B. | 气态氢化物的稳定性:X>Z | |
| C. | 最高价氧化物对应水化物的酸性:Y>W | |
| D. | Z、W均可与Mg形成离子化合物 |
12.有机物C5H11Cl的同分异构体有几种( )
| A. | 6 | B. | 7 | C. | 8 | D. | 9 |
13.下列说法正确的是( )
| A. | 向 0.1 mol/L的氨水中加少量硫酸铵固体,则溶液中$\frac{c(O{H}^{-})}{(N{H}_{3}•{H}_{2}O)}$增大 | |
| B. | 常温下,0.1 mol/L一元酸(HA)溶液的 pH=3,则该溶液中,c2(H+)=c(H+)×c(A-)+Kw | |
| C. | 向含有 1 mol KAl(SO4)2 的溶液中加入 Ba(OH)2 溶液得到沉淀的物质的量最多为 2 mol | |
| D. | 将 Ca(ClO)2、Na2SO3、FeCl3、NaAlO2 溶液蒸干均得不到原溶质 |
 (R为烃基).其中一种辣椒素酯类化合物J的合成路线如下:
(R为烃基).其中一种辣椒素酯类化合物J的合成路线如下:

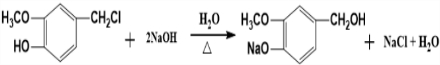 .
. .
.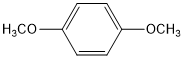 (写结构简式).
(写结构简式).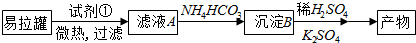
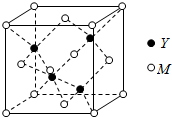 M是第四周期元素,最外层只有1个电子,次外层的所有原子轨道均充满电子.元素Y的负一价离子的最外层电子数与次外层的相同.回答下列问题:
M是第四周期元素,最外层只有1个电子,次外层的所有原子轨道均充满电子.元素Y的负一价离子的最外层电子数与次外层的相同.回答下列问题: