题目内容
13.下列说法正确的是( )| A. | 向 0.1 mol/L的氨水中加少量硫酸铵固体,则溶液中$\frac{c(O{H}^{-})}{(N{H}_{3}•{H}_{2}O)}$增大 | |
| B. | 常温下,0.1 mol/L一元酸(HA)溶液的 pH=3,则该溶液中,c2(H+)=c(H+)×c(A-)+Kw | |
| C. | 向含有 1 mol KAl(SO4)2 的溶液中加入 Ba(OH)2 溶液得到沉淀的物质的量最多为 2 mol | |
| D. | 将 Ca(ClO)2、Na2SO3、FeCl3、NaAlO2 溶液蒸干均得不到原溶质 |
分析 A.加入硫酸铵后,铵根离子浓度增大,抑制了一水合氨的电离,则溶液中氢氧根离子浓度减小,一水合氨的浓度增大;
B.c2(H+)=c(H+)×c(A-)+Kw的两边同时除以氢离子浓度可得c(H+)=c(A-)+c(OH-),然后结合电荷守恒判断;
C.1mol KAl(SO4)2含有1molAl3+,2molSO42-,开始发生反应SO42-+Ba2+=BaSO4↓,Al3++3OH-=A1(OH)3↓,Al3+完全沉淀,再继续滴加Ba(OH)2溶液,发生反应A1(OH)3+OH-=A1O2-+2H2O,SO42-+Ba2+=BaSO4↓,判断Al3+完全沉淀后再滴加Ba(OH)2溶液沉淀量的物质的量变化,确定沉淀量最大时发生的反应,注意此时钡离子与氢氧根离子为1:2;
D.NaAlO2溶液加热时水解生成的氢氧化铝和氢氧化钠,氢氧化铝与氢氧化钠最终又反应生成NaAlO2.
解答 解:A.向 0.1 mol/L的氨水中加少量硫酸铵固体,一水合氨的电离程度减小,溶液中企业广告离子浓度减小,一水合氨的浓度增大,则$\frac{c(O{H}^{-})}{(N{H}_{3}•{H}_{2}O)}$的比值减小,故A错误;
B.常温下,0.1 mol/L一元酸(HA)溶液的pH=3,说明HA为弱酸,在溶液中存在电离平衡,将c2(H+)=c(H+)×c(A-)+Kw的两边同时除以氢离子浓度可得c(H+)=c(A-)+c(OH-),该等式满足HA溶液中的电荷守恒,故B正确;
C.1mol KAl(SO4)2含有1molAl3+、2molSO42-,开始发生反应SO42-+Ba2+=BaSO4↓、Al3++3OH-=A1(OH)3↓,由方程式可知当加入1.5molBa(OH)2时,Al3+完全沉淀,SO42-反应1.5mol,SO42-有剩余,再继续滴加Ba(OH)2溶液,发生反应A1(OH)3+OH-=A1O2-+2H2O,SO42-+Ba2+=BaSO4,由方程式可知加入1molBa(OH)2,溶解2molA1(OH)3,生成1molBaSO4,沉淀的物质的量减少,故当Al3+恰好沉淀时,生成的沉淀的物质的量最大,此时加入1.5molBa(OH)2,由SO42-+Ba2+=BaSO4↓可知生成硫酸钡沉淀1.5mol,由Al3++3OH-=A1(OH)3↓可知生成氢氧化铝沉淀1mol,故沉淀物质的量最大为1.5mol+1mol=2.5mol,故C错误;
D.Ca(ClO)2、Na2SO3、FeCl3溶液蒸干均得不到原溶质,而NaAlO2溶液加热时虽能水解,但生成的氢氧化铝和氢氧化钠最终又反应生成NaAlO2,可得到溶质固体,故D错误;
故选B.
点评 本题考查了弱电解质的电离平衡及其应用,题目难度中等,明确盐的水解原理、弱电解质的电离特点为解答关键,C为易错点,注意铝离子完全沉淀时生成沉淀的物质的量最大,试题培养了学生的分析能力及灵活应用能力.

| A. | 四种元素中离子半径最大的为M | |
| B. | Y、Z、M的氢化物中,M的氢化物沸点最高 | |
| C. | 四种元素最多可形成两种盐 | |
| D. | 由四种元素中的两种形成的相对分子质量最小的有机物,不能发生加成反应 |
| A. | Y的氢化物的沸点比R的氢化物的沸点高 | |
| B. | Z、W、R按最高价氧化物对应水化物的酸性强弱排列顺序是R>W>Z | |
| C. | X2Y2化合物中的化学键与X2R中的化学键类型完全相同 | |
| D. | RY2通入Ba(NO3)2溶液中有白色沉淀生成,该沉淀不溶于硝酸 |
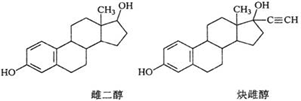
| A. | 能与Na、NaOH溶液、Na2CO3溶液反应 | |
| B. | 能发生加成反应、取代反应、消去反应 | |
| C. | 该分子中所有碳原子不可能在同一个平面内 | |
| D. | 可与FeCl3溶液发生显色反应,但不能与O2发生氧化反应 |

 .
. +nOHCH2CH2OH$\stackrel{一定条件}{→}$
+nOHCH2CH2OH$\stackrel{一定条件}{→}$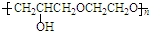 +nHCl
+nHCl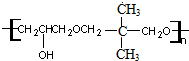 .
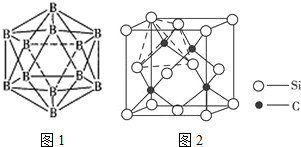
.
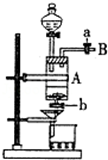 三氯化铁是中学化学实验室中常用的化学试剂.同学们利用废铁屑(含少量铜杂质)来探究制备FeCl3•6H2O的方法,同学甲设计的实验装置如图所示,其实验步骤如下:A中放有废铁屑,烧杯中盛有足量的稀硝酸,实验时先打开a并关闭b,用分液漏斗向A中加入过量的盐酸充分反应,此时溶液呈浅绿色;再打开b进行过滤,过滤结束后,取烧杯内溶液倒入蒸发皿加热,蒸发掉部分水并使剩余HNO3分解,再降温结晶得FeCl3•6H2O晶体.
三氯化铁是中学化学实验室中常用的化学试剂.同学们利用废铁屑(含少量铜杂质)来探究制备FeCl3•6H2O的方法,同学甲设计的实验装置如图所示,其实验步骤如下:A中放有废铁屑,烧杯中盛有足量的稀硝酸,实验时先打开a并关闭b,用分液漏斗向A中加入过量的盐酸充分反应,此时溶液呈浅绿色;再打开b进行过滤,过滤结束后,取烧杯内溶液倒入蒸发皿加热,蒸发掉部分水并使剩余HNO3分解,再降温结晶得FeCl3•6H2O晶体.