题目内容
3.A、B、C、D、E五种短周期主族元素,它们的原子序数依次增大.已知:A和C、B和D分别位于同主族,且B、D质子数之和是A、C质子数之和的2倍.下列说法正确的是( )| A. | 原子半径的大小顺序:r(B)>r(C)>r(D) | |
| B. | C的最高价氧化物对应水化物的碱性在同周期中最强 | |
| C. | E分别与A、C形成的化合物中化学键类型相同 | |
| D. | B的简单气态氢化物的热稳定性比D的弱 |
分析 有A、B、C、D、E五种短周期元素,它们的原子序数依次增大,A和C、B和D分别位于同主族,假设A是H元素,B的原子序数小于C,则C是Na元素,且B、D质子数之和是A、C质子数之和的2倍,则B是O元素,D是S元素,所以假设成立,E为主族的短周期元素,且原子序数最大,E是Cl元素,结合对应单质化合物的性质以及元素周期率知识解答该题.
解答 解:有A、B、C、D、E五种短周期元素,它们的原子序数依次增大,A和C、B和D分别位于同主族,假设A是H元素,B的原子序数小于C,则C是Na元素,且B、D质子数之和是A、C质子数之和的2倍,则B是O元素,D是S元素,所以假设成立,E为主族的短周期元素,且原子序数最大,E是Cl元素,
A.原子核外电子层数越多,原子半径越大,应为Na>S>O,故A错误;
B.C为Na,在第三周期中金属性最强,最高价氧化物对应水化物的碱性在同周期中最强,故B正确;
C.E分别与A、C形成的化合物分别为氯化氢、氯化钠,分别为共价化合物和离子化合物,化学键类型不同,故C错误;
D.非金属性O>S,非金属性越强,对应的氢化物越稳定,故D错误;
故选B.
点评 本题考查原子结构与元素周期律的关系,为高考常见题型和高频考点,题目难度不大,本题的关键是根据原子结构特点正确推断元素的种类.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
13.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 4.6g由NO2和N2O4组成的混合物中氧原子总数为0.2NA | |
| B. | 标准状况下,22.4L的SO3中含3NA个氧原子 | |
| C. | 100mL18.4mol/L的浓硫酸与足量的铜加热反应,转移的电子数为1.84NA | |
| D. | 密闭的容器中,催化剂作用下0.5molN2与1.5molH2反应后得到NH3分子数一定为NA |
14.用NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | 常温下,0.1mol•L-1的碳酸钠溶液中含有的阴离子数大于0.1NA | |
| B. | 标况下33.6mL氯气通入足量水中发生反应,转移电子数为1.5×10-3NA | |
| C. | 常温常压下,28克由C3H6和C4H8组成的混合气体中含共用电子对数目为6NA个 | |
| D. | 同温下,pH=1体积为1L的硫酸溶液所含氢离子数与pH=13体积为1L的氢氧化钠溶液所含氢氧根离子数均为0.1NA |
11.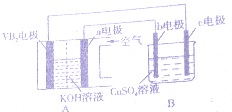 碱性硼化钒(VB2),-空气电池工作时反应为:4VB2+1lO2=4B203+2V205.用该电池为电源,选用惰性电极电解硫酸铜溶液,实验装置如图所示.当外电路中通过0.04mol电子时,B装置内共收集到 0.448L气体(标推状况)下列说法正确的是( )
碱性硼化钒(VB2),-空气电池工作时反应为:4VB2+1lO2=4B203+2V205.用该电池为电源,选用惰性电极电解硫酸铜溶液,实验装置如图所示.当外电路中通过0.04mol电子时,B装置内共收集到 0.448L气体(标推状况)下列说法正确的是( )
 碱性硼化钒(VB2),-空气电池工作时反应为:4VB2+1lO2=4B203+2V205.用该电池为电源,选用惰性电极电解硫酸铜溶液,实验装置如图所示.当外电路中通过0.04mol电子时,B装置内共收集到 0.448L气体(标推状况)下列说法正确的是( )
碱性硼化钒(VB2),-空气电池工作时反应为:4VB2+1lO2=4B203+2V205.用该电池为电源,选用惰性电极电解硫酸铜溶液,实验装置如图所示.当外电路中通过0.04mol电子时,B装置内共收集到 0.448L气体(标推状况)下列说法正确的是( )| A. | VB2电极发生的电极反应为:2VB2+11H20-22e-═V205+2B203+22H+ | |
| B. | 若B装置内液体的体积一直为200mL,则原CuS04溶液浓度为0.05 mol/L | |
| C. | 电解过程中,b电极表面先有红色物质析出,然后有气泡产生 | |
| D. | 外电路中电子由c电极流向VB2电极 |
18.下列说法正确的是,( NA表示阿伏加德罗常数的值)( )
| A. | 在常温常压下,11.2升氯气含有的分子数为0.5NA | |
| B. | 在常温常压下,1摩氦气含有的原子数为2NA | |
| C. | 在常温常压下,32克氧气所含原子数目为2NA | |
| D. | 在同温同压时,相同体积的任何气体单质所含的原子数目相同 |
8.100mL 1mol•L-1的Ca(HCO3)2溶液中,放入2.3g金属钠充分反应后,有关物质的物理量正确的是(NA表示阿伏加德罗常数)( )
| 生成CaCO3 | 溶液中HCO3- | H2 | 转移的电子 | |
| A | 0.1NA | 0.1NA | ||
| B | 1.12L | 0.1NA | ||
| C | 10g | 0.05NA | ||
| D | 10g | 0.1NA |
| A. | A | B. | B | C. | C | D. | D |
15.用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 1mol Na2O2与水完全反应时转移电子的数为2NA | |
| B. | 常温下,100mL 1mol•L-1 Na2CO3溶液中CO${\;}_{3}^{2-}$离子数为0.1NA | |
| C. | 1mol FeCl3与足量水反应转化为氢氧化铁胶体后,其中胶体粒子数为NA | |
| D. | 一定条件下催化分解80g SO3,混合气体中氧原子数为3NA |
12.下列有关叙述正确的是( )
| A. | 据悉中国在建的第二艘航母中使用了素有“现代工业的骨骼”之称的碳纤维,碳纤维是一种新型的有机高分子材料 | |
| B. | 离子交换膜在工业上应用广泛,如氯碱工业使用阴离子交换膜 | |
| C. | 获得屠呦呦女士用乙醚从黄花蒿中提取出青蒿素,该技术应用了萃取原理 | |
| D. | 酸碱指示剂变色、煤的液化、蛋白质的颜色反应、海水提取溴、焰色反应都涉及化学变化 |
