题目内容
15.亚氯酸钠(NaClO2)是一种强氧化性漂白剂,在碱性环境中稳定存在.NaClO2 饱和溶液在低于38℃时析出的晶体是NaClO2•3H2O,高于38℃时析出晶体是NaCl02,高于60℃时NaCl02分解成NaClO3和NaCl.工业生产NaClO2的主要流程如下: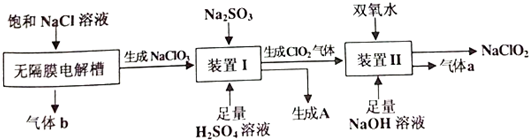
请回答下列问题:
(1)在无隔膜电解槽中电解饱和NaCI溶液生产氯酸钠时,阴极产物是H2和NaOH.
(2)装置I中反应时须使NaClO3稍微过量,目的是防止生成的ClO2气体中混有SO2杂质,引起产品不纯.
(3)装置Ⅱ中发生反应的离子方程式为2ClO2+H2O2+2OH-=2ClO2-+O2↑+2H2O.该反应须保证溶液的碱性在一定pH范围内,下列可精确检测反应过程中溶液酸碱性,且对NaCl02的纯度和产率不会造成影响的是c.
a.酚酞试液 b.pH试纸 c.pH计
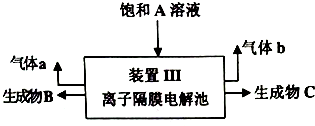
(4)装置Ⅰ中生成物A的化学式是Na2SO4,为降低生产成本,实现物质的再利用,用装置Ⅲ电解A的饱和溶液,部分产物可作为装置Ⅰ和装置Ⅱ的反应物,其中可为装置Ⅱ提供的物质为C(选填“B”、“C”).
(5)从装置Ⅱ反应后的溶液获得NaCl02晶体的操作步骤为:①减压,55℃蒸发结晶;②趁热过滤;③用38-
60℃的温水洗涤;④低于60℃干燥,得到产品,采取“减压蒸发”而不用“常压蒸发”的原因是常压蒸发温度过高,NaClO2容易分解.
(6)某学习小组用碘最法测定产品中NaCl02的含量,实验如下:
a.准确称取所得NaCl02样品1.0g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应,将所得混合液配成250mL待测溶液.(己知:ClO2-+4I-+4H+=2H20+2I2+Cl-)
b.移取25.00mL待测溶液于锥形瓶中,加几滴淀粉溶液,用0.2000mol•L-1 Na2S203标准液滴定至终点.重复滴定2次.(已知:I2+2S2O32-=2I-+S4O62-)
①达到滴定终点时的现象为滴入最后一滴标准溶液,溶液由蓝色变化为无色且半分钟不变化.某次滴定达到终点时滴定管液面刻度如图,读数为22.40.
②若3次滴定平均消耗Na2S203溶液的体积为20.00mL,则样品中NaCl02的质量分数为90.5%.

分析 饱和NaCl溶液在无隔膜电解槽中电解阳极得到NaClO3,阴极得到氢气;装置I中NaClO3在酸性条件下被Na2SO3还原成ClO2,同时得到氧化产物A为Na2SO4;ClO2在碱性条件下与双氧化水混合,被还原为NaClO2,同时得氧化产物a为氧气;装置Ⅲ有离子隔膜的电解槽电解Na2SO4溶液,可知气体a为O2,该极为阳极,OH-放电,c(H+)增大,SO42-移向该极,所以B为硫酸溶液,阴极生成氢气,H+放电,生成C为NaOH;据此分析答题:
(1)根据工艺流程图无隔膜电解槽阴极周围溶液里H+得电子发生还原反应生成氢气;
(2)装置I中NaClO3在酸性条件下被Na2SO3还原成ClO2,NaClO3稍微过量,则Na2SO3完全被氧化成硫酸钠,否则过剩的Na2SO3会与稀硫酸反应生成SO2;
(3)Ⅱ中发生二氧化氯与双氧水在碱性条件下反应生成NaClO2和氧气,根据电子得失守恒分析配平;酚酞试纸只能测定溶液的酸碱性并污染溶液,pH试纸只能粗略测定溶液的pH,而pH计可准确测定溶液的pH;
(4)装置I中NaClO3在酸性条件下被Na2SO3还原成ClO2,同时得到氧化产物A为Na2SO4;装置Ⅲ有离子隔膜的电解槽电解Na2SO4溶液,得到B为硫酸溶液,生成C为NaOH,可结合装置Ⅱ中发生的反应判断;
(5)减压蒸馏可降低沸点,而从装置Ⅱ反应后的溶液获得的NaCl02晶体受热易分解;
(6)①滴定过程中发生反应是酸性溶液中ClO2-能被I-完全还原成Cl-,碘离子被氧化为碘单质,溶液中Na2S2O3能与I2反应:2Na2S2O3+I2=2NaI+Na2S4O6.溶液颜色蓝色变化为无色分析判断反应终点;滴定管读数应精确到0.01mL,且每一小隔为0.01mL;
②依据ClO2-+4H++4I-=2I2+Cl-+2H2O,2Na2S2O3+I2=2NaI+Na2S4O6,反应的定量关系计算得到;
解答 解:饱和NaCl溶液在无隔膜电解槽中电解阳极得到NaClO3,阴极得到氢气;装置I中NaClO3在酸性条件下被Na2SO3还原成ClO2,同时得到氧化产物A为Na2SO4;ClO2在碱性条件下与双氧化水混合,被还原为NaClO2,同时得氧化产物a为氧气;装置Ⅲ有离子隔膜的电解槽电解Na2SO4溶液,可知气体a为O2,该极为阳极,OH-放电,c(H+)增大,SO42-移向该极,所以B为硫酸溶液,阴极生成氢气,H+放电,生成C为NaOH;据此分析答题:
(1)根据工艺流程图无隔膜电解槽阴极H+发生还原反应生成氢气,同时破坏水的电离平衡,溶液里OH-浓度增大,得到NaOH,故答案为:H2和NaOH;
(2)装置I中为防止Na2SO3过量并与稀硫酸反应生成SO2,使得生成的ClO2不纯,需使NaClO3稍微过量,故答案为:防止生成的ClO2气体中混有SO2杂质,引起产品不纯;
(3)Ⅱ中发生二氧化氯与双氧水在碱性条件下反应生成NaClO2和氧气,所以方程式为:2ClO2+H2O2+2OH-=2ClO2-+O2+2H2O;可选择pH计准确测定溶液的PH,且不污染溶液,故答案为:2ClO2+H2O2+2OH-=2ClO2-+O2+2H2O;c;
(4)装置Ⅰ中亚硫酸钠的氧化产物为硫酸钠,装置Ⅱ中需要提供足量NaOH,而装置Ⅲ电解产生C为NaOH,故答案为:Na2SO4;C;
(5)常压蒸馏与减压蒸馏的区别就是减压蒸馏时可降低溶液的沸点,而NaClO2高温易分解,则就选择减压蒸馏,避免晶体分解,故答案为:常压蒸发温度过高,NaClO2容易分解;
(6)①步骤Ⅱ中发生反应是酸性溶液中ClO2-能被I-完全还原成Cl-,碘离子被氧化为碘单质,离子方程式为:ClO2-+4H++4I-=2I2+Cl-+2H2O,溶液中Na2S2O3能与I2反应:2Na2S2O3+I2=2NaI+Na2S4O6.溶液颜色蓝色变化为无色分析判断反应终点,滴入最后一滴标准溶液,溶液由蓝色变化为无色且半分钟不变化;滴定管内液面对应读数为22.40;
故答案为:滴入最后一滴标准溶液,溶液由蓝色变化为无色且半分钟不变化;22.40;
②依据ClO2-+4H++4I-=2I2+Cl-+2H2O,2Na2S2O3+I2=2NaI+Na2S4O6,反应的定量关系计算得到,设NaClO2物质的量为x,
ClO2-~2I2~4Na2S2O3
1 4
x 0.20mol/L×20×10-3L
x=$\frac{0.20mol/L×20×1{0}^{-3}L}{4}$=1×10-3mol
样品中NaClO2的质量分数=$\frac{1×1{0}^{-3}mol×\frac{250}{25}×90.5g/mol}{1.0g}$×100%=90.5%,
故答案为:90.5%;
点评 本题以学生比较陌生的亚氯酸钠制备为背景,以过氧化氢法制备亚氯酸钠为主线,考察学生阅读题目获取信息的能力、对浓度概念的理解、对氧化还原反应相关知识的运用、有关实验操作和简单实验设计能力考察以及在新情境下综合运用知识解决问题的能力.题目有一定的难度.

| A. | 1mol Na2O2与水完全反应时转移电子的数为2NA | |
| B. | 常温下,100mL 1mol•L-1 Na2CO3溶液中CO${\;}_{3}^{2-}$离子数为0.1NA | |
| C. | 1mol FeCl3与足量水反应转化为氢氧化铁胶体后,其中胶体粒子数为NA | |
| D. | 一定条件下催化分解80g SO3,混合气体中氧原子数为3NA |
| A. | 可生成H2的质量为0.02g | |
| B. | 可生成氢的原子数为2.408×1023个 | |
| C. | 可生成H2的体积为0.224L(标准情况) | |
| D. | 生成H2的量理论上等于0.04mol Na与水反应产生H2的量 |
| A. | 如果存放有钠、电石等危险化学品的仓库着火,消防员不能用水灭火,应用泡沫灭火器灭火 | |
| B. | 用石英制成光导纤维,由水玻璃制硅胶都是化学变化 | |
| C. | 火法炼铜、湿法炼铜都是置换反应 | |
| D. | 糖类、油脂、蛋白质都是高分子化合物 |
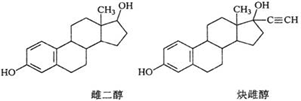
| A. | 能与Na、NaOH溶液、Na2CO3溶液反应 | |
| B. | 能发生加成反应、取代反应、消去反应 | |
| C. | 该分子中所有碳原子不可能在同一个平面内 | |
| D. | 可与FeCl3溶液发生显色反应,但不能与O2发生氧化反应 |

 X、Y、Z、W、R、Q为前30号元素,且原子序数依次增大.X的最高正价和最低负价的绝对值相等,Y有三个能级,且每个能级上的电子数相等,Z原子未成对电子数在同周期元素中最多,W与Z同周期,第一电离能比Z的低,R与Y同一主族,Q的最外层只有一个电子,其他电子层电子均处于饱和状态.请回答下列问题:
X、Y、Z、W、R、Q为前30号元素,且原子序数依次增大.X的最高正价和最低负价的绝对值相等,Y有三个能级,且每个能级上的电子数相等,Z原子未成对电子数在同周期元素中最多,W与Z同周期,第一电离能比Z的低,R与Y同一主族,Q的最外层只有一个电子,其他电子层电子均处于饱和状态.请回答下列问题: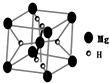 开发新型储氢材料是氢能利用的重要研究方向.
开发新型储氢材料是氢能利用的重要研究方向. .
. +nOHCH2CH2OH$\stackrel{一定条件}{→}$
+nOHCH2CH2OH$\stackrel{一定条件}{→}$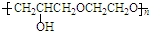 +nHCl
+nHCl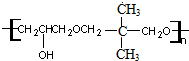 .
.