题目内容
8.短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示.已知Y、W的原子序数之和是Z的3倍,下列说法正确的是( )| Y | Z | ||
| X | W |
| A. | 原子半径:X<Y<Z | |
| B. | 气态氢化物的稳定性:X>Z | |
| C. | 最高价氧化物对应水化物的酸性:Y>W | |
| D. | Z、W均可与Mg形成离子化合物 |
分析 Y、W的原子序数之和是Z的3倍,设Y的原子序数为x,则Z的原子序数为x+1,W的原子序数为x+10,则x+x+10=3×(x+1),解得x=7,即Y为N,结合位置关系可知,Z为O,X为Si,W为Cl,然后结合元素周期律的知识来解答.
解答 解:Y、W的原子序数之和是Z的3倍,设Y的原子序数为x,则Z的原子序数为x+1,W的原子序数为x+10,则x+x+10=3×(x+1),解得x=7,即Y为N,结合位置关系可知,Z为O,X为Si,W为Cl.
A.同周期自左而右原子半径减小,电子层越多原子半径越大,则原子半径为X>Y>Z,故A错误;
B.非金属性越强,气态氢化物越稳定,则气态氢化物的稳定性为X<Z,故B错误;
C.Cl的最高价氧化物对应水化物的酸性为含氧酸中酸性最强的酸,非金属性越强最高价含氧酸的酸性越强,故最高价氧化物对应水化物的酸性:W>Y,故C错误;
D.Z、W可与Mg形成离子化合物氧化镁、氯化镁,故D正确;
故选:D.
点评 本题可知位置、结构与性质关系,熟练掌握周期表的计算,根据原子序数的关系推断元素为解答的关键,注意对元素周期律的理解应用,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
8.100mL 1mol•L-1的Ca(HCO3)2溶液中,放入2.3g金属钠充分反应后,有关物质的物理量正确的是(NA表示阿伏加德罗常数)( )
| 生成CaCO3 | 溶液中HCO3- | H2 | 转移的电子 | |
| A | 0.1NA | 0.1NA | ||
| B | 1.12L | 0.1NA | ||
| C | 10g | 0.05NA | ||
| D | 10g | 0.1NA |
| A. | A | B. | B | C. | C | D. | D |
9.下列物质不可用作食品添加剂的是( )
| A. | 谷氨酸单钠 | B. | 柠檬酸 | C. | 山梨酸钾 | D. | 三聚氰胺 |
17.X、Y、Z、R、W是原子序数依次增大的五种短周期元素.Y和R同主族,可组成共价化合物RY2,Y和Z最外层电子数之和与W的最外层电子数相同,25℃时,0.1mol/L X和W形成化合物的水溶液pH为1.下列说法正确的是( )
| A. | 由于非金属性Y>R,所以X、Y组成化合物的沸点高于X、R组成的化合物 | |
| B. | Y和其他四种元素均可形成至少两种的二元化合物 | |
| C. | RY2能与Y、Z形成的一种化合物反应生成Y2 | |
| D. | Y、Z、W三种元素组成化合物的水溶液一定显碱性 |
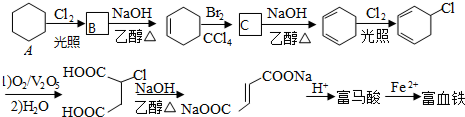
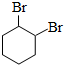 .
. .
.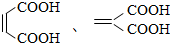 (写出结构简式).
(写出结构简式).

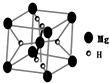 开发新型储氢材料是氢能利用的重要研究方向.
开发新型储氢材料是氢能利用的重要研究方向.