题目内容
11.将0.50molSO2(g)和0.30molO2(g)放入容积为10L的密闭容器中发生反应:2SO2(g)+O2(g)?2SO3(g),并在一定条件下达到平衡,测得c(SO3)=0.040mol/L.计算该条件下反应的平衡常数K和SO2的平衡转化率(用三段式写出计算过程)分析 将0.50molSO2(g)和0.30molO2(g)放入容积为10L的密闭容器中,在一定条件下达到平衡,测得c(SO3)=0.040mol/L,则:
2SO2(g)+O2(g)?2SO3(g)
起始浓度(mol/L):0.05 0.03 0
变化浓度(mol/L):0.04 0.02 0.04
平衡浓度(mol/L):0.01 0.01 0.04
再根据K=$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{3})×c({O}_{2})}$计算平衡常数,转化率=$\frac{浓度变化量}{起始浓度}$×100%.
解答 解:将0.50molSO2(g)和0.30molO2(g)放入容积为10L的密闭容器中,在一定条件下达到平衡,测得c(SO3)=0.040mol/L,则:
2SO2(g)+O2(g)?2SO3(g)
起始浓度(mol/L):0.05 0.03 0
变化浓度(mol/L):0.04 0.02 0.04
平衡浓度(mol/L):0.01 0.01 0.04
平衡常数K=$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{3})×c({O}_{2})}$=$\frac{(0.04mol/L)^{2}}{(0.01mol/L)^{2}×0.01mol/L}$=1600L/mol,
SO2的平衡转化率=$\frac{0.04mol/L}{0.05mol/L}$×100%=80%,
答:平衡常数为1600 L/mol,二氧化硫的转化率为80%.
点评 本题考查化学平衡计算,难度不大,掌握三段式在化学平衡计算中应用.

也可用作有机合成中间体、溶剂等.其制备方法为:

已知(Mr=122)(Mr=150)
| 颜色、状态 | 沸点(℃) | 密度(g•cm-3) | |
| 苯甲酸* | 无色、片状晶体 | 249 | 1.2659 |
| 苯甲酸乙酯 | 无色澄清液体 | 212.6 | 1.05 |
| 乙醇 | 无色澄清液体 | 78.3 | 0.7893 |
| 环己烷 | 无色澄清液体 | 80.8 | 0.7318 |
实验步骤如下:
①在100mL圆底烧瓶中加入12.20g苯甲酸、25mL乙醇(过量)、20mL环己烷,以及4mL浓硫酸,混合均匀并加入沸石,按如图所示装好仪器,并在分水器中预先加入水,使水面略低于分水器的支管口,控制温度在65~70℃加热回流2h.反应时环己烷-乙醇-水会形成“共沸物”(沸点62.6℃)蒸馏出来.在反应过程中,通过分水器下部的旋塞分出生成的水,注意保持分水器中水层液面原来的高度,使油层尽量回到圆底烧瓶中.
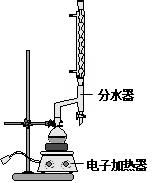
②反应结束,打开旋塞放出分水器中液体后,关闭旋塞.继续加热,至分水器中收集到的液体不再明显增加,停止加热.
③将烧瓶内反应液倒入盛有适量水的烧杯中,分批加入Na2CO3至溶液呈中性.
④用分液漏斗分出有机层,水层用25mL乙醚萃取分液,然后合并至有机层.加入氯化钙,对粗产物进行蒸馏(装置如右图所示),低温蒸出乙醚后,继续升温,接收210~213℃的馏分.
⑤检验合格,测得产品体积为12.86mL.
回答下列问题:
(1)步骤①中使用分水器不断分离除去水的目的是使平衡不断地向正向移动,从而提高产品产率
(2)反应结束的标志分水器中的水层不再增加时,视为反应的终点.
(3)步骤②中应控制馏分的温度在C.
A.65~70℃B.78~80℃C.85~90℃D.215~220℃
(4)若Na2CO3加入不足,在步骤④蒸馏时,蒸馏烧瓶中可见到白烟生成,产生该现象的原因是苯甲酸乙酯中混有未除净的苯甲酸,在受热至100℃时发生升华.
(5)关于步骤④中的分液操作叙述正确的是AD.
A.水溶液中加入乙醚,转移至分液漏斗中,塞上玻璃塞.将分液漏斗倒转过来,用力振摇
B.振摇几次后需打开分液漏斗上口的玻璃塞放气
C.经几次振摇并放气后,手持分液漏斗静置待液体分层
D.放出液体时,需将玻璃塞上的凹槽对准漏斗口上的小孔
(6)蒸馏时所用的玻璃仪器除了酒精灯、冷凝管、接收器、锥形瓶外还有蒸馏烧瓶、温度计.
(7)该实验的产率为90%.
| A. | H2SO4 | B. | Cl2 | C. | NaAlO2 | D. | NH3 |
| A. | 形成较多的白色沉淀 | |
| B. | 排除SO42-以外的其它阴离子及Ag+的干扰 | |
| C. | 形成的沉淀纯度更高 | |
| D. | 排除Ba2+以外的其它阳离子的干扰 |
①N2(g)+O2(g)?2NO(g)的平衡常数K=3.84×10-31;
②2SO2(g)+O2(g)?2SO3(g)的平衡常数K=3.10×1025.
则在该温度下,两个化学反应的反应程度之间的关系为( )
| A. | ①>② | B. | ①<② | C. | ①=② | D. | 不能确定 |
| A. | 过滤 | B. | 蒸馏 | ||
| C. | 用半透膜进行渗析 | D. | 蒸发 |
| A. | 用惰性电极电解饱和食盐水,每转移1mol电子,生成11.2L的H2 | |
| B. | 1molMg与足量的N2完全反应时,转移的电子数为3NA | |
| C. | 精炼铜时,当阳极质量减少6.4g时,电路中转移电子数为0.2NA | |
| D. | 常温下,11.2L的甲烷气体中含有的氢、碳原子数之比为4:1 |
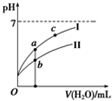 已知:25℃时,下列4种溶液.请回答下列问题.
已知:25℃时,下列4种溶液.请回答下列问题.