题目内容
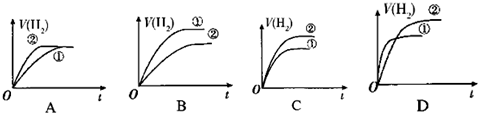
2.已知R是短周期元素,存在以下反应:RO3-+6I-+6H+═Rn-+3I2+3H2O.下列叙述正确的是( )| A. | R是ⅤA族元素 | B. | n=2 | ||
| C. | R 是最外层有7个电子,只能是氯 | D. | Rn-还原性大于 I- |
分析 由RO3-+6I-+6H+═Rn-+3I2+3H2O可知,R元素的化合价由+5价降低为0,I元素的化合价升高1价,结合电荷守恒可知n=1,R的最低价为-1价,则最高价为+7价,则R属于第ⅤⅡA元素,以此来解答.
解答 解:由RO3-+6I-+6H+═Rn-+3I2+3H2O可知,R元素的化合价由+5价降低为0,I元素的化合价升高1价,结合电荷守恒可知n=1,R的最低价为-1价,则最高价为+7价,则R属于第ⅤⅡA元素,
A.由分析可知,R属于第ⅤⅡA元素,故A错误;
B.结合电荷守恒可知n=1,故B错误;
C.已知R是短周期元素,R属于第ⅤⅡA元素,则R最外层有7个电子,只能是氯,故C正确;
D.反应中I-作还原剂,还原剂的还原性大于还原产物,则Rn-还原性小于 I-,故D错误;
故选C.
点评 本题考查氧化还原反应,把握反应中元素的化合价变化为解答的关键,侧重元素的化合价和性质及分析与应用能力的考查,注意电荷守恒和电子守恒的应用,题目难度不大.

练习册系列答案
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案
相关题目
13.某温度下,在体积为2L的密闭容器中充入1mol A和b mol B气体,发生如下反应:A(g)+B(g)?2C(g),5min后反应达到平衡时n(A)为0.4mol.在反应过程中体系的温度持续升高,实验测得混合气体中C的含量与温度的关系如下图所示.下列叙述正确的是( )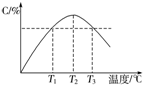

| A. | 0~5 min,C物质的平均反应速率为0.04 mol•L-1•min-1 | |
| B. | 图中温度T1时的正反应速率等于温度T3时的正反应速率 | |
| C. | 该反应温度T2时的平衡常数大于温度T3时的平衡常数 | |
| D. | 图中T2时,若只增大压强,则正、逆反应速率不改变 |
7.短周期元素X、Y、Z、W的原子序数依次增大,X和Z同主族,Y和W同主族,原子半径X小于Y,四种元素原子最外层电子数之和为14.下列叙述正确的是( )
| A. | 同周期元素中W的最高价氧化物对应水化物的酸性最强 | |
| B. | 氢化物的热稳定性:HnY>HnW | |
| C. | Y和X、Z和X组成的常见化合物中化学键的类型相同 | |
| D. | 原子半径的大小顺序:rW>rZ>rY>rX |
14. 实验室采购了部分化学药品.如图是从化学试剂商店买回的硫酸试剂标签上的部分内容.下列说法正确的是( )
实验室采购了部分化学药品.如图是从化学试剂商店买回的硫酸试剂标签上的部分内容.下列说法正确的是( )
 实验室采购了部分化学药品.如图是从化学试剂商店买回的硫酸试剂标签上的部分内容.下列说法正确的是( )
实验室采购了部分化学药品.如图是从化学试剂商店买回的硫酸试剂标签上的部分内容.下列说法正确的是( )| A. | 该硫酸的物质的量浓度为9.2mol•L-1 | |
| B. | 1molAl与足量的该硫酸反应产生3g氢气 | |
| C. | 这种硫酸在常温下不能使铁钝化 | |
| D. | 配制80mL2.3mol•L-1的稀硫酸需量取该硫酸12.5 mL |
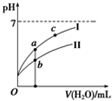 已知:25℃时,下列4种溶液.请回答下列问题.
已知:25℃时,下列4种溶液.请回答下列问题.