题目内容
5.席夫碱类化合物在催化、药物等方面用途广泛.某种席夫碱C的合成路线如图: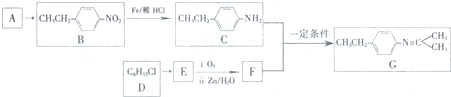
已知
①
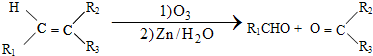
②A属于芳香烃,其相对分子质量为106.
③RNH2+
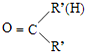 $\stackrel{一定条件}{→}$R-N=C
$\stackrel{一定条件}{→}$R-N=C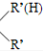 +H2O
+H2O④1molE可生成2molF
(1)A的名称为乙苯(乙基苯),B→C的反应类型为还原反应.
(2)D→E的化学反应方程式为CH3CH(CH3)CCl(CH3)2+NaOH$→_{△}^{醇}$(CH3)2C=C(CH3)2+NaCl+H2O.
(3)E自身发生聚合反应生成的高分子化合物的结构简式为
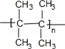 .
.(4)根据以上信息,分析以下合成路线:
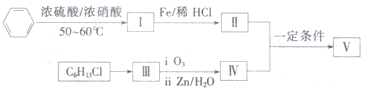
已知:1molⅢ能生成2mol IV,IV能发生银镜反应.
①Ⅱ的结构简式为C6H5NH2,V的结构简式为C6H5N=CHCH2CH3.
②Ⅲ的反式结构简式为
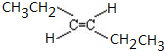 .
.③Ⅴ的同分异构体中符合下列条件的共有8种(不考虑顺反异构).
i.含苯环和碳碳双键; ii.苯环上有两种氢.
分析 在席夫碱G的合成中,A属于单取代芳烃,其相对分子质量为106,B含有一个苯环,侧链式量=106-77=29,故侧链为-CH2CH3,A为 ;D的分子式为C6H13Cl,为己烷的一氯代物,在一定条件下反应得到E,1mol E发生信息④中氧化反应生成2mol F,所以 E为对称结构烯烃,且F与
;D的分子式为C6H13Cl,为己烷的一氯代物,在一定条件下反应得到E,1mol E发生信息④中氧化反应生成2mol F,所以 E为对称结构烯烃,且F与 发生信息③中的反应生成
发生信息③中的反应生成 ,故E为(CH3)2C=C(CH3)2,F为(CH3)2C=O,逆推可知D为(CH3)2CH-CCl(CH3)2,
,故E为(CH3)2C=C(CH3)2,F为(CH3)2C=O,逆推可知D为(CH3)2CH-CCl(CH3)2,
(4)在物质V的合成中,苯与混酸在50-60℃时反应产物Ⅰ为硝基苯,硝基苯在Fe/稀HCl的条件下被还原为Ⅱ为C6H5NH2,1molⅢ能生成2mol IV,IV能发生银镜反应,根据C6H13Cl及信息①可知,C6H13Cl的结构简式为CH3CH2CHClCH2CH2CH3,C6H13Cl发生消去反应生成Ⅲ为CH3CH2CH=CHCH2CH3,Ⅲ发生氧化反应生成Ⅳ为CH3CH2CHO,Ⅱ和Ⅳ发生信息③中的反应生成Ⅴ为C6H5N=CHCH2CH3,据此答题.
解答 解:在席夫碱G的合成中,A属于单取代芳烃,其相对分子质量为106,B含有一个苯环,侧链式量=106-77=29,故侧链为-CH2CH3,A为 ;D的分子式为C6H13Cl,为己烷的一氯代物,在一定条件下反应得到E,1mol E发生信息④中氧化反应生成2mol F,所以 E为对称结构烯烃,且F与
;D的分子式为C6H13Cl,为己烷的一氯代物,在一定条件下反应得到E,1mol E发生信息④中氧化反应生成2mol F,所以 E为对称结构烯烃,且F与 发生信息③中的反应生成
发生信息③中的反应生成 ,故E为(CH3)2C=C(CH3)2,F为(CH3)2C=O,逆推可知D为(CH3)2CH-CCl(CH3)2,
,故E为(CH3)2C=C(CH3)2,F为(CH3)2C=O,逆推可知D为(CH3)2CH-CCl(CH3)2,
(1)A为 ,A的名称为 乙苯(乙基苯),比较B和C的结构简式可知,B中的硝基发生还原反应生成C中的氨基,
,A的名称为 乙苯(乙基苯),比较B和C的结构简式可知,B中的硝基发生还原反应生成C中的氨基,
故答案为:乙苯(乙基苯);还原反应;
(2)D→E的化学反应方程式为CH3CH(CH3)CCl(CH3)2+NaOH$→_{△}^{醇}$(CH3)2C=C (CH3)2+NaCl+H2O,
故答案为:CH3CH(CH3)CCl(CH3)2+NaOH$→_{△}^{醇}$(CH3)2C=C (CH3)2+NaCl+H2O;
(3)E为(CH3)2C=C(CH3)2,E自身发生加聚反应生成的高分子化合物的结构简式为 ,
,
故答案为: ;
;
(4)在物质V的合成中,苯与混酸在50-60℃时反应产物Ⅰ为硝基苯,硝基苯在Fe/稀HCl的条件下被还原为Ⅱ为C6H5NH2,1molⅢ能生成2mol IV,IV能发生银镜反应,根据C6H13Cl及信息①可知,C6H13Cl的结构简式为CH3CH2CHClCH2CH2CH3,C6H13Cl发生消去反应生成Ⅲ为CH3CH2CH=CHCH2CH3,Ⅲ发生氧化反应生成Ⅳ为CH3CH2CHO,Ⅱ和Ⅳ发生信息③中的反应生成Ⅴ为C6H5N=CHCH2CH3,
①根据上面的分析可知,Ⅱ的结构简式为 C6H5NH2,V的结构简式为C6H5N=CHCH2CH3,
故答案为:C6H5NH2;C6H5N=CHCH2CH3;
②Ⅲ为CH3CH2CH=CHCH2CH3,Ⅲ的反式结构简式为  ,
,
故答案为: ;
;
③Ⅴ为C6H5N=CHCH2CH3,根据条件i.含苯环和碳碳双键; ii.苯环上有两种氢,即苯环上有两个处于对位的基团,则符合条件的Ⅴ的同分异构体为
 ,共有8种,
,共有8种,
故答案为:8.
点评 本题考查有机物的推断与合成,注意利用各物质的结构与反应条件进行推断,需要学生熟练掌握官能团的性质与转化,既注重基础知识巩固训练,又较好的考查学生分析推理能力与知识迁移应用,答题时注意正确运用题中信息,难度中等.

 名校课堂系列答案
名校课堂系列答案| A. | 煤的气化和液化都是物理变化 | |
| B. | BaSO4在医学上用作钡餐,Ba2+对人体无毒 | |
| C. | PM2.5是指粒径在2.5微米以下的颗粒物,其在空气中形成的分散系属于胶体 | |
| D. | Na、K合金熔点低,可用作原子反应堆的导热剂 |

| A. | SO2(g)+2CO(g)═S(s)+2CO2(g)△H=-(2b-a)kJ•mol-1 | |
| B. | SO2(g)+2CO(g)═S(s)+2CO2(g)△H=-(b-a)kJ•mol-1 | |
| C. | SO2(g)+2CO(g)═S(s)+2CO2(g)△H=(2b-a)kJ•mol-1 | |
| D. | SO2(g)+2CO(g)═S(s)+2CO2(g)△H=-(2b+a)kJ•mol-1 |
| A. | HNO3 | B. | Cu | C. | SO2 | D. | NH4NO3 |
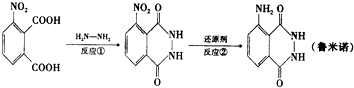
若反应②在催化剂作用下用H2还原,则制备1mol目标产物,理论上反应①与反应②生成水的质量比为( )
| A. | 1:2 | B. | 1:1 | C. | 2:1 | D. | 2:3 |

| A. | 分离Na2CO3溶液和苯,选④ | B. | 用CCl4提取碘水中的碘,选③ | ||
| C. | 用FeCl2溶液吸收Cl2,选⑤ | D. | 粗盐提纯,选①和② |
(1)CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H1=-870.3kJ/mol
(2)C(s)+O2(g)═CO2(g)△H2=-393.5kJ/mol
(3)2H2(g)+O2(g)═2H2O(l)△H3=-571.6kJ/mol
则反应2C(s)+2H2(g)+O2(g)═CH3COOH(l)的焓变为( )
| A. | -488.3 kJ/mol | B. | -244.15 kJ/mol | C. | 488.3 kJ/mol | D. | 244.15 kJ/mol |