题目内容
16.CO对人类生存环境的影响很大,CO治理问题属于当今社会的热点问题.镍与CO反应的化学方程式为Ni(s)+4CO(g)?Ni(CO)4(g),镍与CO反应会造成镍催化剂中毒,、为防止镍催化剂中毒,工业上常用SO2除去CO,生成物为S和 CO2.已知相关反应过程的能量变化如图所示,则用SO2除去CO的热化学方程式为( )
| A. | SO2(g)+2CO(g)═S(s)+2CO2(g)△H=-(2b-a)kJ•mol-1 | |
| B. | SO2(g)+2CO(g)═S(s)+2CO2(g)△H=-(b-a)kJ•mol-1 | |
| C. | SO2(g)+2CO(g)═S(s)+2CO2(g)△H=(2b-a)kJ•mol-1 | |
| D. | SO2(g)+2CO(g)═S(s)+2CO2(g)△H=-(2b+a)kJ•mol-1 |
分析 图1:S(s)+O2(g)=SO2(g)△H1=-aKJ/mol
图2:CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H2=-bKJ/mol;
依据盖斯定律②×2-①得到,由此分析解答.
解答 解:图1:S(s)+O2(g)=SO2(g)△H1=-aKJ/mol
图2CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H2=-bKJ/mol;
依据盖斯定律②×2-①得到:SO2(g)+2CO(g)=S(s)+CO2(g)△H=2△H2-△H1=-(2b-a)KJ/mol,
故选A.
点评 考查了反应热的问题,对学生综合运用知识能力有一定的要求,特别是根据图中信息热化学方程式,要求学生有较好从图中获取信息的能力,整个题目难度较大.

练习册系列答案
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目
7.下列关于Na2CO3和NaHCO3性质的说法中,正确的是( )
| A. | 常温时在水中的溶解性:NaHCO3>Na2CO3 | |
| B. | 热稳定性:NaHCO3<Na2CO3 | |
| C. | 与酸反应的快慢:NaHCO3<Na2CO3 | |
| D. | Na2CO3不能转化成NaHCO3,而NaHCO3能转化成Na2CO3 |
4.下列方法可以加快铁和稀硫酸反应速率的是( )
| A. | 加入少量硫酸锌 | B. | 加入少量硫酸铜 | C. | 降温 | D. | 增大压强 |
11.下列说法正确的是( )
| A. | 增大压强,化学反应速率一定加快 | |
| B. | 其它条件不变,温度越高,反应速率越快 | |
| C. | 同时改变两个变量来研究反应速率的变化,能更快得出有关规律 | |
| D. | 增加反应物的量,反应速率一定加快 |
1.海水总量极大.金,铀等微量元素在海水中的总量自然也大,但从海水中获取这些微量元素的成本很高.其中成本最高的步骤在于( )
| A. | 从海水中富集含微量元素的化合物 | B. | 使含微量元素的离子沉淀 | ||
| C. | 对含微量元素的混合物进行提纯 | D. | 从化合物中冶炼这些单质 |
8.下列物质分类正确的是( )
| A. | NO2、Cl2O7都是酸性氧化物 | B. | 水银、水玻璃都是混合物 | ||
| C. | 干冰、可燃冰都是分子晶体 | D. | HD、HCHO都是极性分子 |
6.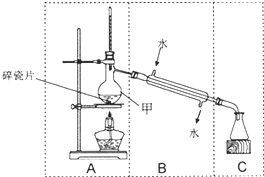 如图装置在中学化学实验中常用于物质的分离与提纯.
如图装置在中学化学实验中常用于物质的分离与提纯.
(1)加入药品之前要检验装置的气密性
(2)仪器甲的名称是蒸馏烧瓶.B中仪器的名称冷凝管
(3)上图存在一处错误,请指出存在错误的区域B(填“A”、“B”或“C”).
(4)图中错误改正后,该装置可完成下列实验中的C(填序号).
 如图装置在中学化学实验中常用于物质的分离与提纯.
如图装置在中学化学实验中常用于物质的分离与提纯.(1)加入药品之前要检验装置的气密性
(2)仪器甲的名称是蒸馏烧瓶.B中仪器的名称冷凝管
(3)上图存在一处错误,请指出存在错误的区域B(填“A”、“B”或“C”).
(4)图中错误改正后,该装置可完成下列实验中的C(填序号).
| A.除去CO2气体中混有的少量HCl气体 |
| B.从硝酸钾和氯化钠的混合物中提纯得到硝酸钾 |
| C.用含有Fe3+的自来水获得少量纯净的水 |
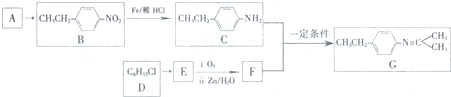
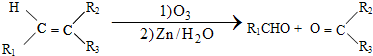
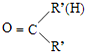 $\stackrel{一定条件}{→}$R-N=C
$\stackrel{一定条件}{→}$R-N=C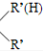 +H2O
+H2O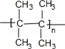 .
.
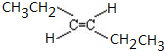 .
.