题目内容
13.将2.44克的BaCl2•XH2O配制成100ml溶液,25ml此溶液中的Cl-恰好能与50ml 0.1mol/L的AgNO3溶液完全反应,计算:(1)2.44克的BaCl2•XH2O的物质的量为0.01moL;
(2)x的值2.
分析 (1)发生反应Ag++Cl-=AgCl↓,据此计算10mL溶液中n(Cl-),进而计算100mL溶液中n(Cl-),溶液中n(Ba2+)=$\frac{1}{2}$n(Cl-),求物质的量;
(2)根据M=$\frac{m}{n}$计算BaCl2•XH2O摩尔质量,进而计算X的值.
解答 解:(1)50ml 0.1mol/L的AgNO3溶液中n(Ag+)=0.05L×0.1mol/L=0.005mol,由Ag++Cl-=AgCl↓可知,所以10mL氯化钡溶液中n(Cl-)=0.005mol,100mL溶液中n(Cl-)=0.005mol×$\frac{100mL}{25ml}$=0.02mol,故100mL溶液中n(Ba2+)=$\frac{1}{2}$n(Cl-)=0.01mol,所以2.44克的BaCl2•XH2O的物质的量为0.01moL,故答案为:0.01moL;
(2)2.44克的BaCl2•XH2O的物质的量为0.01moL,故其摩尔质量=$\frac{2.44克}{0.01摩尔}$=224g/mol,故244=18x+208,解得x=2,
故答案为:2.
点评 本题考查物质的量浓度有关计算、离子方程式有关计算等,比较基础,关键是根据离子方程式确定氯离子的物质的量.

练习册系列答案
相关题目
3.下列与盐的水解有关的是( )
①NH4Cl与ZnCl2溶液可作焊接金属中的除锈剂 ②用NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火剂 ③草木灰与铵态氮肥不能混合施用 ④实验室盛放Na2CO3溶液的试剂瓶不能用磨口玻璃塞.
①NH4Cl与ZnCl2溶液可作焊接金属中的除锈剂 ②用NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火剂 ③草木灰与铵态氮肥不能混合施用 ④实验室盛放Na2CO3溶液的试剂瓶不能用磨口玻璃塞.
| A. | ①②③ | B. | ②③④ | C. | ①②③④ | D. | ①④ |
4.下列方法可以加快铁和稀硫酸反应速率的是( )
| A. | 加入少量硫酸锌 | B. | 加入少量硫酸铜 | C. | 降温 | D. | 增大压强 |
1.海水总量极大.金,铀等微量元素在海水中的总量自然也大,但从海水中获取这些微量元素的成本很高.其中成本最高的步骤在于( )
| A. | 从海水中富集含微量元素的化合物 | B. | 使含微量元素的离子沉淀 | ||
| C. | 对含微量元素的混合物进行提纯 | D. | 从化合物中冶炼这些单质 |
8.下列物质分类正确的是( )
| A. | NO2、Cl2O7都是酸性氧化物 | B. | 水银、水玻璃都是混合物 | ||
| C. | 干冰、可燃冰都是分子晶体 | D. | HD、HCHO都是极性分子 |
3.下列溶液中粒子的物质的量浓度关系正确的是( )
| A. | 20mL 0.1mol/L CH3COONa溶液与10mL 0.1mol/L HCl溶液混合后溶液呈酸性,所得溶液中:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) | |
| B. | 0.1mol/L NaHCO3溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-) | |
| C. | 室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)+c(H+)>c(NH4+)+c(OH-) | |
| D. | 0.1mol/L CH3COOH溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中:c(OH-)>c(H+)+c(CH3COOH) |
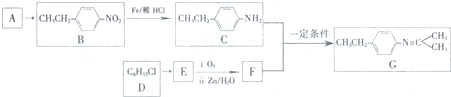
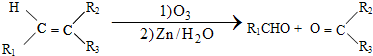
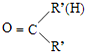 $\stackrel{一定条件}{→}$R-N=C
$\stackrel{一定条件}{→}$R-N=C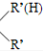 +H2O
+H2O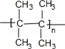 .
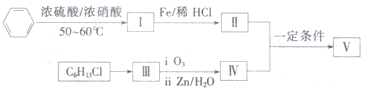
.
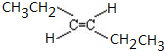 .
.