题目内容
2.下列卤代烃在KOH醇溶液中加热不反应的是( )①
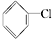 ②
②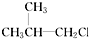 ③(CH3)3CCH2Cl ④CHCl2CHBr2⑤
③(CH3)3CCH2Cl ④CHCl2CHBr2⑤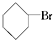 ⑥CH3Cl.
⑥CH3Cl.| A. | 全部 | B. | ②③⑤ | C. | ①③⑥ | D. | ②④ |
分析 消去反应是指在一定条件下,有机物脱去小分子生成含有不饱和键的有机物.卤代烃的消去反应是在碱的醇溶液中加热,连接-X的碳的相邻碳原子上的一个H和-X一同被脱去,而生成不饱和烃和卤化氢,如邻位碳原子不连接氢原子或为卤苯等,则不发生消去反应,以此解答该题.
解答 解:①有机物发生消去反应发生后将会形成不饱和键,而氯苯氯苯中相邻的碳原子是苯环的一部分,若消去再形成双键破坏苯环结构,故不能发生消去反应,故①正确;
②和氯相连的碳的相邻碳原子上有氢,故能消去,生成对应的烯烃和氯化钾,故②错误;
③和氯相连的碳的相邻碳原子上没有氢,所以不能发生消去反应.故③正确;
④和氯或溴相连的碳相邻碳原子上有氢,故能消去,生成对应的烯烃或炔烃和氯化钾,故④错误;
⑤和溴相连的碳上有氢,故能发生消去反应,生成对应的烯烃和氯化钾,故⑤错误;
⑥卤代烃中连在卤原子的碳原子必须有相邻的碳原子且此相邻的碳原子上,并且还必须连有氢原子时,才可发生消去反应,而该题中一氯甲烷只有一个碳,没有相邻的碳,所以不能发生消去反应.故⑥正确;
故选C.
点评 本题考查有机物的结构和性质,为高频考点,题目侧重考查卤代烃的消去,难度不大,注意掌握卤代烃消去的原理,连接-X的碳的相邻碳原子上必须有氢,需要注意的是C6H5Cl不能发生消去反应.

练习册系列答案
 活力课时同步练习册系列答案
活力课时同步练习册系列答案 学业测评一课一测系列答案
学业测评一课一测系列答案
相关题目
13. Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物.现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响.
Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物.现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响.
[实验设计]控制p-CP的初始浓度相同,恒定实验温度在298K或313K(其余实验条件见下表),设计如下对比实验.
(1)请完成以下实验设计表中横线上的内容.
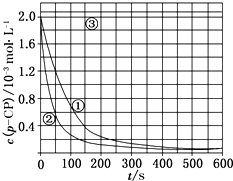
[数据处理]实验测得p-CP的浓度随时间变化的关系如图.
(2)根据如图实验①曲线,计算降解反应50~150s内的反应速率:v(p-CP)=8.0×10-6mol•L-1•s-1. (3)实验①、②表明温度升高,降解反应速率增大.但温度过高时反而导致降解反应速率减小,请从Fenton法所用试剂H2O2的角度分析原因:H2O2在温度过高时迅速分解.
(4)实验时需在不同时间从反应器中取样,并使所取样品中的反应立即停止下来.根据上图中的信息,给出一种迅速停止反应的方法:在溶液中加入碱溶液,使溶液的pH大于或等于10.
 Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物.现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响.
Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物.现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响.[实验设计]控制p-CP的初始浓度相同,恒定实验温度在298K或313K(其余实验条件见下表),设计如下对比实验.
(1)请完成以下实验设计表中横线上的内容.
| 实验编号 | 实验目的 | T/K | pH | c/10-3 mol•L-1 | |
| H2O2 | Fe2+ | ||||
| ① | 为以下实验作参照 | 298 | 3 | 6.0 | 0.30 |
| ② | 探究温度对降解反应速率的影响 | 313 | |||
| ③ | 探究溶液的pH对降解反应速率的影响 | 298 | 10 | 6.0 | 0.30 |
(2)根据如图实验①曲线,计算降解反应50~150s内的反应速率:v(p-CP)=8.0×10-6mol•L-1•s-1. (3)实验①、②表明温度升高,降解反应速率增大.但温度过高时反而导致降解反应速率减小,请从Fenton法所用试剂H2O2的角度分析原因:H2O2在温度过高时迅速分解.
(4)实验时需在不同时间从反应器中取样,并使所取样品中的反应立即停止下来.根据上图中的信息,给出一种迅速停止反应的方法:在溶液中加入碱溶液,使溶液的pH大于或等于10.
10.设NA表示阿伏加德罗常数.下列说法正确的是( )
| A. | 标准状况下,11.2L N2O4中含有的分子数目为0.5NA | |
| B. | 常温常压下,10.4g苯乙烯中含有的碳碳双键数目为0.1NA | |
| C. | 标准状况下,0.1mol Cl2溶于水,转移的电子数目为0.1NA | |
| D. | 常温常压下,0.1mol单质硅和二氧化硅中含有的共价键数目都是0.2NA |
17.在通常条件下,下列各组物质的比较排列不正确的是( )
| A. | 沸点:正戊烷>2-甲基丁烷>乙烷 | B. | 同分异构体种类:戊烯<戊烷 | ||
| C. | 密度:苯<水<硝基苯 | D. | 含碳量:乙烯>乙烷 |
3.硼有两种天然同位素${\;}_5^{10}$B和${\;}_5^{11}$B,硼元素的近似相对原子质量为10.80,则对硼元素中${\;}_5^{10}$B的物质的量分数的判断正确的是( )
| A. | 10% | B. | 20% | C. | 50% | D. | 80% |
1.有主族元素A、B、C、D、E,相对位置如图所示.C的原子序数是D的两倍.
(1)E位于元素周期表中第四周期,第VA族,该周期共有18种元素
(2)上述五种元素的最高价氧化物对应的水化物酸性最强的是(写酸的化学式)H2SO4
(3)上述五种元素的氢化物稳定性最强的是(写氢化物的化学式)H2O,用电子式表示该物质的形成过程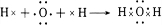 .
.
| D | ||
| A | B | C |
| E |
(2)上述五种元素的最高价氧化物对应的水化物酸性最强的是(写酸的化学式)H2SO4
(3)上述五种元素的氢化物稳定性最强的是(写氢化物的化学式)H2O,用电子式表示该物质的形成过程
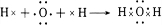 .
. 
 .
.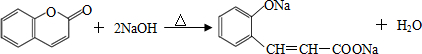 .
. (任意2种)(任写两种).
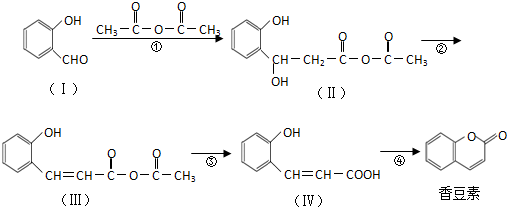
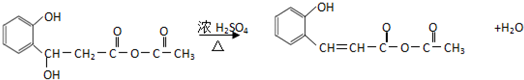
(任意2种)(任写两种).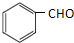 与CH3CHO能发生类似反应①、②的两步反应,最终生成的有机物的结构简式为
与CH3CHO能发生类似反应①、②的两步反应,最终生成的有机物的结构简式为 .
.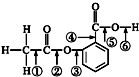 阿司匹林的结构简式如图,①②③④⑤⑥分别标出了其分子中不同的键.请判断阿司匹林与乙醇发生反应时,断键的位置是( )
阿司匹林的结构简式如图,①②③④⑤⑥分别标出了其分子中不同的键.请判断阿司匹林与乙醇发生反应时,断键的位置是( )