题目内容
7.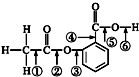 阿司匹林的结构简式如图,①②③④⑤⑥分别标出了其分子中不同的键.请判断阿司匹林与乙醇发生反应时,断键的位置是( )
阿司匹林的结构简式如图,①②③④⑤⑥分别标出了其分子中不同的键.请判断阿司匹林与乙醇发生反应时,断键的位置是( )| A. | ⑤ | B. | ⑥ | C. | ③ | D. | ② |
分析 根据阿斯匹林的结构简式可知,分子中含有羧基,决定其具有羧酸的性质;分子中具有酯基,决定其具有酯的性质,能和乙醇反应的是羧基,以此解答该题.
解答 解:阿司匹林含有羧基,与乙醇发生酯化反应,羧基中C-O键断裂,即⑤键断裂,
故选A.
点评 本题考查有机物的结构与性质,注意把握羧基、酯基的性质即可解答,注意化学键断裂与图中位置的对应关系,题目难度不大.

练习册系列答案
 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案
相关题目
17.下列说法正确的是( )
| A. | 12C、13C、14C、石墨都是碳元素的同位素 | |
| B. | 同种元素的原子,质量数一定相同 | |
| C. | 互为同位素的原子,质子数一定相同 | |
| D. | 由一种元素组成的物质,一定是纯净物 |
15.下列实验装置、操作能达到实验目的是( )
| A. |  测定中和热 | B. |  反应快慢 | C. |  粗铜的电解精炼 | D. |  电解食盐水 |
2.下列卤代烃在KOH醇溶液中加热不反应的是( )
①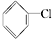 ②
②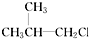 ③(CH3)3CCH2Cl ④CHCl2CHBr2⑤
③(CH3)3CCH2Cl ④CHCl2CHBr2⑤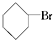 ⑥CH3Cl.
⑥CH3Cl.
①
 ②
②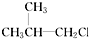 ③(CH3)3CCH2Cl ④CHCl2CHBr2⑤
③(CH3)3CCH2Cl ④CHCl2CHBr2⑤ ⑥CH3Cl.
⑥CH3Cl.| A. | 全部 | B. | ②③⑤ | C. | ①③⑥ | D. | ②④ |
1.下列物质能使有色布条褪色的是( )
| A. | 干燥的氯气 | B. | 潮湿的氯气 | C. | 干燥的次氯酸钙 | D. | 氯化钙 |
8.下列关于锂的说法正确的是( )
| A. | 碱金属中Li的还原性最强 | B. | 碱金属阳离子,氧化性最强的是Li+ | ||
| C. | 和Li同一主族的都是金属元素 | D. | Li在空气中加热生成过氧化锂 |
5. 常温下,浓度均为0.10mol/L、体积均为V0的HA和HB溶液,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化如图所示,下列叙述正确的是( )
常温下,浓度均为0.10mol/L、体积均为V0的HA和HB溶液,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化如图所示,下列叙述正确的是( )
 常温下,浓度均为0.10mol/L、体积均为V0的HA和HB溶液,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化如图所示,下列叙述正确的是( )
常温下,浓度均为0.10mol/L、体积均为V0的HA和HB溶液,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化如图所示,下列叙述正确的是( )| A. | 该温度下HB的电离平衡常数约等于1.11×10-5 | |
| B. | 当lg$\frac{V}{{V}_{0}}$=3时,若两溶液同时升高温度,则$\frac{c({B}^{-})}{c({A}^{-})}$减小 | |
| C. | 相同条件下NaA溶液的pH大于NaB溶液的pH | |
| D. | 溶液中水的电离程度:a=c>b |
6.下列物质中,既含有离子键,又含有共价键的是( )
| A. | H2O2 | B. | NaOH | C. | CaO | D. | SO2 |
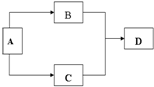 由主族元素组成的A、B、C、D四种常见物质,有如图所示转换关系(部分反应物、生成物没有列出).且四种物质均含有同一种元素.
由主族元素组成的A、B、C、D四种常见物质,有如图所示转换关系(部分反应物、生成物没有列出).且四种物质均含有同一种元素.