题目内容
19.现有25℃时0.1mol/L的氨水,请回答下列问题:(1)若向氨水中加入稀硫酸,使其恰好完全中和,写出反应的离子方程式:NH3•H2O+H+═NH4++H2O;所得溶液的pH<7(填“>”、“<”或“=”),用离子方程式表示其原因:NH4++H2O?NH3•H2O+H+;根据所得溶液的物料守衡关系,将下列等式补充完整,c(SO42-)=$\frac{1}{2}$[c(NH4+)+c(NH3•H2O)].
(2)若向氨水中加入稀硫酸至溶液的pH=7,此时c(NH4+)=a mol/L,则c(SO42-)=$\frac{a}{2}$ mol•L-1.
(3)若向氨水中加入pH=1的硫酸,且氨水与硫酸的体积比为1:1,则所得溶液中各离子的物质的量浓度由大到小的顺序是c(NH4+)>c(SO42-)>c(H+)>c(OH-).
分析 (1)硫酸和氨水反应生成硫酸铵和水,硫酸铵是强酸弱碱盐水解而使其溶液呈酸性;由物料守恒可知,c(SO42-)是氨的总浓度的一半;
(2)根据溶液中阴阳离子所带电荷相等确定硫酸根离子浓度;
(3)若向氨水中加入pH=1的硫酸,且氨水与硫酸的体积比为1:1,则二者恰好反应生成硫酸铵,硫酸铵是强酸弱碱盐,其溶液呈酸性,结合电荷守恒判断离子浓度大小顺序.
解答 解:(1)硫酸和氨水反应生成硫酸铵和水,离子反应方程式为NH3.H2O+H+=NH4++H2O,硫酸铵是强酸弱碱盐水解而使其溶液呈酸性,水解方程式为:NH4++H2O?NH3.H2O+H+;由物料守恒可知,c(SO42-)是氨的总浓度的一半,即c(SO42-)=$\frac{1}{2}$[c(NH4+)+c(NH3•H2O)];
故答案为:NH3•H2O+H+=NH4++H2O;<;NH4++H2O?NH3.H2O+H+;$\frac{1}{2}$[c(NH4+)+c(NH3•H2O)];
(2)溶液呈中性,则溶液中c(H+)=c(OH-),溶液呈电中性,溶液中存在电荷守恒c(NH4+)+c(H+)=2c(SO42- )+c(OH-),所以c(SO42- )=0.5c(NH4+)=$\frac{a}{2}$mol/l;
故答案为:$\frac{a}{2}$ mol•L-1;
(3)若向氨水中加入pH=1的硫酸,且氨水与硫酸的体积比为1:1,则二者恰好反应生成硫酸铵,硫酸铵为强酸弱碱盐,铵根离子水解而使其溶液呈酸性,pH<7,水解离子方程式为NH4++H2O?NH3•H2O+H+,溶液呈酸性则c(H+)>c(OH-),溶液中存在电荷守恒c(H+)+c(NH4+)=2c(SO42-)+c(OH-),所以 c(NH4+)>c(SO42-),铵根离子水解程度较小,所以c(SO42-)>c(H+),则离子浓度大小顺序是 c(NH4+)>c(SO42-)>c(H+)>c(OH-),
故答案为:c(NH4+)>c(SO42-)>c(H+)>c(OH-).
点评 本题考查了弱电解质的电离,明确弱电解质电离特点是解本题关键,弱电解质的电离常常与离子浓度大小比较、酸碱混合溶液定性判断联合考查,结合物料守恒和电荷守恒解答即可,难度中等.

| A. | 向血红色的Fe(SCN)3溶液中加入少量KI 固体,溶液颜色变浅 | |
| B. | 氨水溶液加水稀释,c(OH-)增大,平衡常数增大 | |
| C. | pH=12的Na0H和Na2S溶液中水的电离程度前者大于后者 | |
| D. | 25℃,Cu(OH)2在水中的溶度积和溶解度比其在Cu(NO3)2溶液中的大 |
| A. | 加入少量Ca(OH)2固体 | B. | 加水稀释 | ||
| C. | 加入少量NaOH固体 | D. | 加少量的Na2CO3固体 |
| A. | 原子核外电子有六种运动状态 | |
| B. | L能层p能级只有一个空轨道 | |
| C. | L能层有两个未成对的电子 | |
| D. | 最外层p能级电子数与次外层电子数相等 |
| 元素代号[ | X | Y | Z | W |
| 原子半径/nm | 0.130 | 0.118 | 0.102 | 0.073 |
| 主要化合价 | +2 | +3 | +6、-2 | -2 |
| A. | X、Y元素的金属性X<Y | |
| B. | 一定条件下,Z单质与W的常见单质直接生成ZW2 | |
| C. | Y的最高价氧化物对应的水化物能溶于稀氨水 | |
| D. | Z的氢化物的沸点比W的氢化物高 |
| A. | 硝酸和氢氧化钠 | B. | 盐酸和氨水 | C. | 硫酸和氢氧化钾 | D. | 醋酸和氢氧化钡 |
| A. | 固体氯化铵和消石灰共热 | B. | 加热浓氨水 | ||
| C. | 浓氨水滴加到碱石灰中 | D. | 加热固体氯化铵 |
 .
.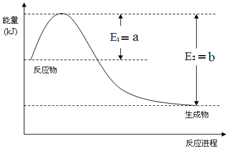 运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义
运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义