题目内容
7.在CO2的水溶液中存在如下平衡体系:CO2+H2O?H2CO3,H2CO3?H++HCO3-,HCO3-?H++CO32-,能使平衡体系均向右移动且使c(CO32-)增大的是( )| A. | 加入少量Ca(OH)2固体 | B. | 加水稀释 | ||
| C. | 加入少量NaOH固体 | D. | 加少量的Na2CO3固体 |
分析 在CO2的水溶液中存在如下平衡体系:CO2+H2O?H2CO3,H2CO3?H++HCO3-,HCO3-?H++CO32-,能使平衡体系均向右移动且使c(CO32-)增大,则要消耗氢离子,据此分析.
解答 解:A.加入少量Ca(OH)2固体,钙离子与碳酸根离子结合生成碳酸钙沉淀,c(CO32-)减小,故A错误;
B.加水稀释,促进碳酸的电离,但是溶液的体积增大,所以c(CO32-)减小,故B错误;
C.加入少量NaOH固体,消耗氢离子,电离平衡向右移动,且使c(CO32-)增大,故C正确;
D.加少量的Na2CO3固体,c(CO32-)增大,使HCO3-?H++CO32-的电离平衡逆向移动,故D错误.
故选C.
点评 本题考查了弱电解质的电离,明确弱电解质电离的影响因素是解本题关键,根据溶液中氢离子浓度变化结合平衡移动方向分析解答,题目难度不大.

练习册系列答案
 目标测试系列答案
目标测试系列答案
相关题目
10.阿替洛尔是一种用于治疗高血压的药物,它的一种合成路线如下:
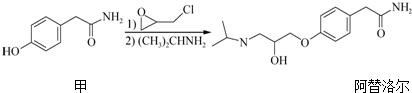
下列说法正确的是( )

下列说法正确的是( )
| A. | 化合物甲的分子式为C8H8O2N | |
| B. | 阿替洛尔分子中含有2个手性碳原子 | |
| C. | 一定条件下,化合物甲与NaOH溶液、浓溴水、H2均可以发生反应 | |
| D. | 阿替洛尔在NaOH乙醇溶液中加热可发生消去反应 |
15.已知0.1mol/L的醋酸溶液中存在CH3COOH?CH3COO-+H+.要使溶液中$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$值增大,可以采取的措施是( )
| A. | 加少量烧碱固体 | B. | 升高温度 | ||
| C. | 加少量冰醋酸 | D. | 加少量醋酸钠固体 |
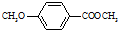
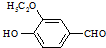 )是食品添加剂的增香原料,其香味比香草醛更加浓郁.
)是食品添加剂的增香原料,其香味比香草醛更加浓郁.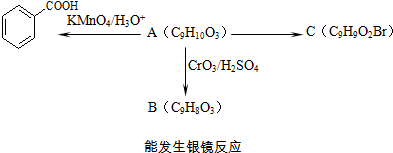
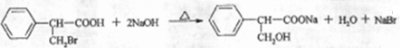
 )是一种医药中间体.
)是一种医药中间体. )合成D.用反应流程图表示如下,请将后面一步的反应条件写在箭头下方,试剂或原料写在箭头上方,中间产物填在图中的方框内.
)合成D.用反应流程图表示如下,请将后面一步的反应条件写在箭头下方,试剂或原料写在箭头上方,中间产物填在图中的方框内.