题目内容
随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.
(1)下列关于CO2的用途不正确的是 (填序号).
A.二氧化碳能溶于水,可用于生产碳酸型饮料
B.固体二氧化碳俗称干冰,可用于人工降雨
C.二氧化碳用于灭火是因为降低了可燃物的着火点
D.超临界二氧化碳作萃取溶剂用于从天然产物提取和净化活性组分
E.二氧化碳可以作为气肥,提高农作物的产量
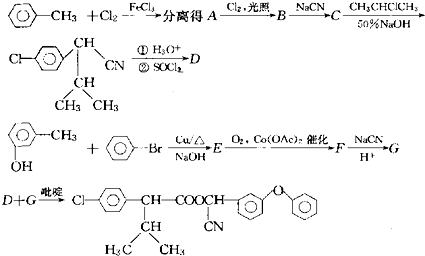
(2)目前工业上有一种方法是用C02来生产甲醇.为探究其反应原理,现进行如下实验,在体积为1L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ.m01-1,测得CO2和CH3OH(g)的浓度随时间变化如图1所示.
①从反应开始到平衡,氢气的平均反应速率:v(H2)= .
②该反应的平衡常数为 .
(3)以KHC03溶液为电解质,用电解的方法也可以将CO2还原为甲醇.请写出电解时阴极的离子方程式:
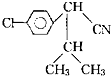
(4)金刚石、石墨烯、线型碳是碳的几种同素异形体.从键的类型分析它们的稳定性由强到弱的顺序为(图2) .
(1)下列关于CO2的用途不正确的是
A.二氧化碳能溶于水,可用于生产碳酸型饮料
B.固体二氧化碳俗称干冰,可用于人工降雨
C.二氧化碳用于灭火是因为降低了可燃物的着火点
D.超临界二氧化碳作萃取溶剂用于从天然产物提取和净化活性组分
E.二氧化碳可以作为气肥,提高农作物的产量
(2)目前工业上有一种方法是用C02来生产甲醇.为探究其反应原理,现进行如下实验,在体积为1L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ.m01-1,测得CO2和CH3OH(g)的浓度随时间变化如图1所示.
①从反应开始到平衡,氢气的平均反应速率:v(H2)=
②该反应的平衡常数为
(3)以KHC03溶液为电解质,用电解的方法也可以将CO2还原为甲醇.请写出电解时阴极的离子方程式:
(4)金刚石、石墨烯、线型碳是碳的几种同素异形体.从键的类型分析它们的稳定性由强到弱的顺序为(图2)

考点:常见的生活环境的污染及治理,不同晶体的结构微粒及微粒间作用力的区别,反应速率的定量表示方法,化学平衡的计算
专题:
分析:(1)A.二氧化碳能与水反应生成了碳酸;
B.干冰在升华时能吸收大量热;
C.根据灭火原理:①清除或隔离可燃物,②隔绝氧气或空气,③使温度降到可燃物的着火点以下,据此结合灭火方法进行分析判断;
D.超临界二氧化碳可做萃取剂;
E.二氧化碳是植物进行光合作用的必要条件,没有二氧化碳,绿色植物就无法进行光合作用.
(2)①由图可知,10min到达平衡,平衡时甲醇的浓度变化为0.75mol/L,由方程式可知氢气的浓度变化等于甲醇的浓度变化量3倍为2.25mol/L,根据v=
计算v(H2);
②利用三段式计算平衡时各组分的平衡浓度,代入平衡常数表达式计算;
(3)由化合价的升降可知,CO2中的碳元素与+4价降到CH3OH中碳元素的-2价,得电子,发生了还原反应;
(4)键能顺序为:碳碳叁键>碳碳双键>碳碳单键.
B.干冰在升华时能吸收大量热;
C.根据灭火原理:①清除或隔离可燃物,②隔绝氧气或空气,③使温度降到可燃物的着火点以下,据此结合灭火方法进行分析判断;
D.超临界二氧化碳可做萃取剂;
E.二氧化碳是植物进行光合作用的必要条件,没有二氧化碳,绿色植物就无法进行光合作用.
(2)①由图可知,10min到达平衡,平衡时甲醇的浓度变化为0.75mol/L,由方程式可知氢气的浓度变化等于甲醇的浓度变化量3倍为2.25mol/L,根据v=
| △c |
| △t |
②利用三段式计算平衡时各组分的平衡浓度,代入平衡常数表达式计算;
(3)由化合价的升降可知,CO2中的碳元素与+4价降到CH3OH中碳元素的-2价,得电子,发生了还原反应;
(4)键能顺序为:碳碳叁键>碳碳双键>碳碳单键.
解答:
解:(1)A.二氧化碳能与水反应生成了碳酸,所以二氧化碳可用于生产碳酸饮料,故A正确;
B.干冰在升华时能吸收大量热,可用于人工降雨,故B正确;
C.二氧化碳用于灭火是因为隔绝空气,故C错误;
D.超临界二氧化碳可做萃取剂从天然产物提取和净化活性组分,故D正确;
E.二氧化碳是植物进行光合作用的必要条件,没有二氧化碳,绿色植物就无法进行光合作用,所以在温室里施用二氧化碳作肥料,可以提高农作物的产量,故E正确.
故答案为:C;
(2)①由图可知,10min到达平衡,平衡时甲醇的浓度变化为0.75mol/L,由方程式CO2(g)+3H2(g)?CH3OH(g)+H2O可知,氢气的浓度变化等于甲醇的浓度变化量为0.75mol/L×3=2.25mol/L,故v(H2)=
=0.225mol/(L?mon);,故答案为:0.225mol?L-1?min-1;
②反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)的平衡常数k=
,
由图可知,10min到达平衡,平衡时甲醇的浓度变化为0.75mol/L,则:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
开始(mol/L):1 3 0 0
变化(mol/L):0.75 2.25 0.75 0.75
平衡(mol/L):0.25 0.75 0.75 0.75
故该温度下平衡常数k=
=5.33( mol?L-1)-2,故答案为:5.33( mol?L-1)-2;
(3)由化合价的升降可知,CO2中的碳元素与+4价降到CH3OH中碳元素的-2价,得电子,发生了还原反应,故:CO2+6e-=CH3OH,溶液为碱性环境,为达到电荷守恒,则CO2+6e-=CH3OH+6OH-,再根据原子守恒得:CO2+5H2O+6e-=CH3OH+6OH-,
故答案为:CO2+6HCO3-+6e-=CH3OH+6CO32-+H2O(或CO2+5H2O+6e-=CH3OH+6OH-);
(4)物质内的键的键能越大,则物质越稳定,由于键能顺序为:碳碳叁键>碳碳双键>碳碳单键,故稳定性由强到弱的顺序为:线型碳>石墨烯>金刚石,故答案为:线型碳>石墨烯>金刚石.
B.干冰在升华时能吸收大量热,可用于人工降雨,故B正确;
C.二氧化碳用于灭火是因为隔绝空气,故C错误;
D.超临界二氧化碳可做萃取剂从天然产物提取和净化活性组分,故D正确;
E.二氧化碳是植物进行光合作用的必要条件,没有二氧化碳,绿色植物就无法进行光合作用,所以在温室里施用二氧化碳作肥料,可以提高农作物的产量,故E正确.
故答案为:C;
(2)①由图可知,10min到达平衡,平衡时甲醇的浓度变化为0.75mol/L,由方程式CO2(g)+3H2(g)?CH3OH(g)+H2O可知,氢气的浓度变化等于甲醇的浓度变化量为0.75mol/L×3=2.25mol/L,故v(H2)=
| 2.25mol/L |
| 10min |
②反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)的平衡常数k=
| c(CH3OH)?c(H2O) |
| c(CO2)?c3(H2) |
由图可知,10min到达平衡,平衡时甲醇的浓度变化为0.75mol/L,则:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
开始(mol/L):1 3 0 0
变化(mol/L):0.75 2.25 0.75 0.75
平衡(mol/L):0.25 0.75 0.75 0.75
故该温度下平衡常数k=
| 0.75×0.75 |
| 0.25×0.753 |
(3)由化合价的升降可知,CO2中的碳元素与+4价降到CH3OH中碳元素的-2价,得电子,发生了还原反应,故:CO2+6e-=CH3OH,溶液为碱性环境,为达到电荷守恒,则CO2+6e-=CH3OH+6OH-,再根据原子守恒得:CO2+5H2O+6e-=CH3OH+6OH-,
故答案为:CO2+6HCO3-+6e-=CH3OH+6CO32-+H2O(或CO2+5H2O+6e-=CH3OH+6OH-);
(4)物质内的键的键能越大,则物质越稳定,由于键能顺序为:碳碳叁键>碳碳双键>碳碳单键,故稳定性由强到弱的顺序为:线型碳>石墨烯>金刚石,故答案为:线型碳>石墨烯>金刚石.
点评:本题考查二氧化碳的用途、反应速率计算、化学平衡的计算与影响因素、平衡常数、电极方程式的书写以及化学键等,难度中等,注意基础知识的掌握.

练习册系列答案
相关题目
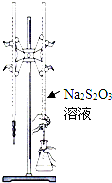 H2S2O3是一种弱酸,实验室欲用0.01mol?L-1的Na2S2O3溶液滴定I2溶液,发生的反应为I2+2Na2S2O3=2NaI+Na2S4O6,下列说法合理的是( )
H2S2O3是一种弱酸,实验室欲用0.01mol?L-1的Na2S2O3溶液滴定I2溶液,发生的反应为I2+2Na2S2O3=2NaI+Na2S4O6,下列说法合理的是( )| A、该滴定可用甲基橙做指示剂 |
| B、Na2S2O3是该反应的还原剂 |
| C、该滴定可选用如图所示装置 |
| D、该反应中每消耗2mol Na2S2O3,电子转移数为4mol |
 一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):
一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO): 为测定某亚硫酸钠样品的纯度,甲同学称取10.0g固体,进行如下实验:
为测定某亚硫酸钠样品的纯度,甲同学称取10.0g固体,进行如下实验: 某有机物M的球棍模型如图所示:
某有机物M的球棍模型如图所示:
 尿素(H2NCONH2)是一种非常重要的高氮化肥,工业上合成尿素的反应分为如下两步:
尿素(H2NCONH2)是一种非常重要的高氮化肥,工业上合成尿素的反应分为如下两步: