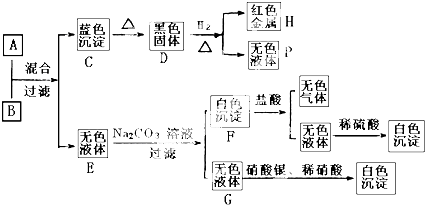
题目内容
 前四周期原子序数依次增大的元素A、B、C、D、E中,A的基态原子核外3个能级上有电子,且每个能级上的电子数相等,B原子核外电子有7种不同的运动状态,C元素原子核外的M层中只有2对成对电子,D+与C2-的电子数相等,E元素位于元素周期表的ds区,且基态原子价层电子均已成对.
前四周期原子序数依次增大的元素A、B、C、D、E中,A的基态原子核外3个能级上有电子,且每个能级上的电子数相等,B原子核外电子有7种不同的运动状态,C元素原子核外的M层中只有2对成对电子,D+与C2-的电子数相等,E元素位于元素周期表的ds区,且基态原子价层电子均已成对.回答下列问题:
(1)E2+的价层电子排布图为
(2)五种元素中第一电离能最小的是
(3)AB+、D+和E2+三种离子组成的化学物质D2E(AB)4,其中化学键的类型有
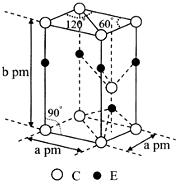
(4)C和E两种元素组成的一个化合物的品胞如图所示.
①该化合物的化学式为
②列示表示该晶体的密度
考点:晶胞的计算,位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题,化学键与晶体结构
分析:前四周期原子序数依次增大的元素A、B、C、D、E中,A的基态原子核外3个能级上有电子,且每个能级上的电子数相等,则A为碳元素,B原子核外电子有7种不同的运动状态,则B为氮元素,C元素原子核外的M层中只有2对成对电子,则C为硫元素,D+与C2-的电子数相等,则D为钾元素,E元素位于元素周期表的ds区,且基态原子价层电子均已成对,则E为锌元素,据此答题.
解答:
解:前四周期原子序数依次增大的元素A、B、C、D、E中,A的基态原子核外3个能级上有电子,且每个能级上的电子数相等,则A为碳元素,B原子核外电子有7种不同的运动状态,则B为氮元素,C元素原子核外的M层中只有2对成对电子,则C为硫元素,D+与C2-的电子数相等,则D为钾元素,E元素位于元素周期表的ds区,且基态原子价层电子均已成对,则E为锌元素,
(1)E为锌元素,E2+的价层电子排布图为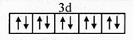 ,
,
故答案为: .
.
(2)元素的金属性越强,第一电离能越小,所以在上面五种元素中第一电离能最小的是 钾元素,SCN-离子中,C与N形成参键,与S形成单键,C原子没有孤电子对,所以C原子的杂化方式是sp杂化,
故答案为:K;sp杂化.
(3)在化合物K2Zn(CN)4为配合物,在这个配合物中化学键的类型有共价键、配位键、离子键,该化合物中存在配合离子的化学式为[Zn(CN)4]2-,配位体是CN-,
故答案为:共价键、配位键、离子键;[Zn(CN)4]2-;CN-;
(4)①根据晶胞结构图,利用均摊法可知,该晶胞中含有S原子数为4×
+4×
+1=2,Zn原子数为4×
+1=2,它们的原子个数比为2:2=1:1,所以该化合物的化学式为ZnS,根据晶胞图,以晶胞体内的Zn原子为例,Zn的配位数为4,S采取六方最密堆积,
故答案为:ZnS;4;六方最密;
②根据晶胞的结构图可知,该晶胞的体积为
a2×10-20×b×10-10cm3=
a2b×10-30cm3,所以晶体的密度为
g?cm-3=
g?cm-3,
故答案为:
.
(1)E为锌元素,E2+的价层电子排布图为
 ,
,故答案为:
 .
.(2)元素的金属性越强,第一电离能越小,所以在上面五种元素中第一电离能最小的是 钾元素,SCN-离子中,C与N形成参键,与S形成单键,C原子没有孤电子对,所以C原子的杂化方式是sp杂化,
故答案为:K;sp杂化.
(3)在化合物K2Zn(CN)4为配合物,在这个配合物中化学键的类型有共价键、配位键、离子键,该化合物中存在配合离子的化学式为[Zn(CN)4]2-,配位体是CN-,
故答案为:共价键、配位键、离子键;[Zn(CN)4]2-;CN-;
(4)①根据晶胞结构图,利用均摊法可知,该晶胞中含有S原子数为4×
| 1 |
| 12 |
| 1 |
| 6 |
| 1 |
| 4 |
故答案为:ZnS;4;六方最密;
②根据晶胞的结构图可知,该晶胞的体积为
| ||
| 2 |
| ||
| 2 |
| ||||
|
| 2×(65+32) | ||||
6.02×1023×
|
故答案为:
| 2×(65+32) | ||||
6.02×1023×
|
点评:本题主要考查了电子排布图、元素周期律、原子杂化方式、配合物、晶胞计算,中等难度,元素推断是解题关键,晶胞计算是本题难度点.

练习册系列答案
相关题目
下列图示与对应的叙述相符的是( )
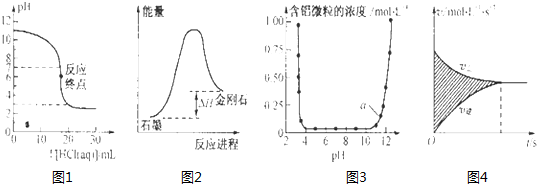

| A、图1表示0.001mol?L-1盐酸滴定0.001mol?L-1NaOH溶液的滴定曲线 |
| B、图2所示,从能量角度考虑,石墨比金刚石稳定 |
| C、图3表示的是Al3+与OH-反应时含铝微粒浓度变化曲线,图中a点溶液中大量存Al3+ |
| D、图4所示,图中的阴影部分面积的含义是[v(正)-v (逆)] |
配制一定物质的量浓度的溶液时,会导致所配溶液浓度偏大的操作是( )
| A、在用蒸馏水洗涤烧杯时,洗涤液未全部注入容量瓶中 |
| B、定容摇匀后,发现液面低于刻度线,又加水到刻度线 |
| C、定容时俯视刻度线 |
| D、用来配制溶液的容量瓶用蒸馏水洗涤后未进行干燥处理 |
如图是氢氧燃料电池构造示意图.关于该电池的说法不正确的是( )
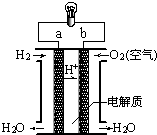

| A、a极是负极 |
| B、正极的电极反应是:O2+2H2O+4e-═4OH- |
| C、电子由a通过灯泡流向b |
| D、氢氧燃料电池是环保电池 |
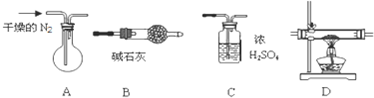
 直接甲醇燃料电池被认为是21世纪电动汽车最佳候选动力源.
直接甲醇燃料电池被认为是21世纪电动汽车最佳候选动力源.