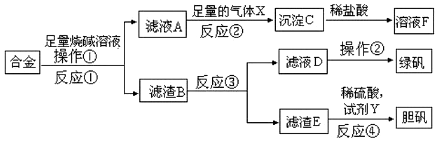
题目内容
12.化学与生产、生活、环境等息息相关,下列有关说法中正确的是( )| A. | 双氧水、高锰酸钾溶液可以杀灭病毒,其消毒原理与二氧化硫漂白丝织物原理相同 | |
| B. | 工业上生产玻璃、水泥、漂白粉及用铁矿石冶炼铁,均需要用石灰石为原料 | |
| C. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| D. | 石油分馏、海水晒盐、燃煤烟气的脱硫、从菜籽中提取菜籽油等过程都是物理变化 |
分析 A.依据二氧化硫能够与有色物质化合生成无色物质,过氧化氢、高锰酸钾具有强的氧化性;
B.制玻璃的原料:石英砂、石灰石、长石、纯碱、硼酸等;制水泥的原料:石灰石和黏土;制漂白粉的原料:用石灰石可以制得氧化钙进而得到消石灰,用氯气与消石灰反应得到漂白粉;
C.绿色化学有助于解决环境污染问题,就是从源头上消除对环境的污染,核心就是利用化学原理从源头消除污染,据此进行分析判断;
D.有新物质生成的为化学变化,没有新物质生成的为物理变化.
解答 解:A.双氧水、高锰酸钾溶液可以杀灭病毒是因为其强的氧化性,二氧化硫漂白丝织物是因为二氧化硫能够与有色物质化合生成无色物质,二者原理不同,故A错误;
B.制玻璃的原料:石英砂、石灰石、长石、纯碱、硼酸等;制水泥的原料:石灰石和黏土;制漂白粉的原料:用石灰石可以制得氧化钙进而得到消石灰,用氯气与消石灰反应得到漂白粉,因此工业上生产玻璃、水泥、漂白粉,均需要用石灰石为原料,故B正确;
C.绿色化学的核心是利用化学原理从源头消除污染,故C错误;
D.燃煤烟气中的二氧化硫用碱性溶液吸收,二氧化硫与碱反应生成亚硫酸盐,有新物质生成,发生化学反应,故D错误;
故选:B.
点评 本题考查了绿色化学、化学变化与物理变化的判断、常见杀菌消毒剂、漂白剂的原理,题目难度不大,侧重于考查化学知识在生产生活中的应用,明确相关物质的性质,熟悉绿色化学的核心是解题关键,注意相关知识的积累.

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
2.Cu粉放入稀H2SO4中,加热后无现象,当加入一种盐后,Cu粉质量减少,而溶液变蓝,同时有气体生成,此盐是( )
| A. | 氯化物 | B. | 硫酸盐 | C. | 硝酸盐 | D. | 碳酸盐 |
3.下列离子方程式正确的是( )
| A. | 醋酸溶液与新制氢氧化铜反应:2H++Cu(OH)2→Cu2++2H2O | |
| B. | 尼泊金酸与碳酸氢钠反应: +2HCO3-→ +2HCO3-→ +2CO2↑+2H2O +2CO2↑+2H2O | |
| C. | 苯酚钠溶液中通入少量二氧化碳:C6H5O-+CO2+H2O→C6H5OH+HCO3- | |
| D. | 甲醛溶液与足量的银氨溶液共热:HCHO+2[Ag(NH3)2]++2OH$\stackrel{△}{→}$CO32-+2NH4++2Ag↓+2NH3+H2O |
4.“类推”常用的学习方法,但有时会产生错误结论.下列类推的结论中,正确的是( )
| A. | IVA族元素氢化物沸点顺序是GeH4>SiH4>CH4,则VA族元素氢化物沸点顺序也是AsH3>PH3>NH3 | |
| B. | 常见的氢化物是分子晶体,则所有氧化物都是分子晶体 | |
| C. | 晶体中有阴离子,必有阳离子;则晶体中有阳离子,也必有阴离子 | |
| D. | 第二周期元素氢化物稳定性顺序是HF>H2O>NH3,则第三周期元素氢化物稳定性顺序也是HCl>H2S>PH3 |
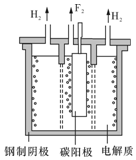 氟是自然界中广泛分布的元素之一.由于氟的特殊化学性质,它和其他卤素在单质及化合物的制备与性质上存在较明显的差异.
氟是自然界中广泛分布的元素之一.由于氟的特殊化学性质,它和其他卤素在单质及化合物的制备与性质上存在较明显的差异.