题目内容
3.下列离子方程式正确的是( )| A. | 醋酸溶液与新制氢氧化铜反应:2H++Cu(OH)2→Cu2++2H2O | |
| B. | 尼泊金酸与碳酸氢钠反应: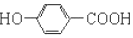 +2HCO3-→ +2HCO3-→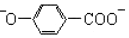 +2CO2↑+2H2O +2CO2↑+2H2O | |
| C. | 苯酚钠溶液中通入少量二氧化碳:C6H5O-+CO2+H2O→C6H5OH+HCO3- | |
| D. | 甲醛溶液与足量的银氨溶液共热:HCHO+2[Ag(NH3)2]++2OH$\stackrel{△}{→}$CO32-+2NH4++2Ag↓+2NH3+H2O |
分析 A.醋酸为弱酸,离子方程式中醋酸不能拆开;
B.酚羟基的酸性小于碳酸氢根离子,酚羟基不参与反应;
C.苯酚的酸性大于碳酸氢根离子,二者反应生成苯酚和碳酸氢钠;
D.甲醛与银氨溶液反应生成碳酸铵、水、银、氨气.
解答 解:A.醋酸溶液与新制氢氧化铜反应,醋酸不能拆开,正确的离子方程式为:2CH3COOH+Cu(OH)2=Cu2++2H2O+2CH3COO-故A错误;
B.酚-OH不与碳酸氢钠反应,则尼泊金酸只有-COOH与碳酸氢钠反应,正确的离子方程式为: +HCO3-→
+HCO3-→ +CO2↑+H2O,故A错误;
+CO2↑+H2O,故A错误;
C.苯酚钠溶液中通入少量二氧化碳的离子反应为C6H5O-+CO2+H2O→C6H5OH+HCO3-,故C正确;
D.甲醛溶液与足量的银氨溶液共热的离子反应为:HCHO+4[Ag(NH3)2]++4OH- $\stackrel{△}{→}$CO32-+2NH4++4Ag↓+6NH3+2H2O,故D错误;
故选C.
点评 本题考查离子反应方程式的书写,侧重有机物性质的考查,注意苯酚的性质及HCHO中含2个-CHO为解答的易错点,注重基础知识的考查,题目难度不大.

练习册系列答案
相关题目
20.下列反应过程中的能量变化与右图一致的是( )
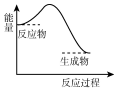

| A. | CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑ | |
| B. | 2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3 | |
| C. | Ba(OH)2•8H2O+2NH4Cl$\frac{\underline{\;研磨\;}}{\;}$BaCl2+2NH3↑+10H2O | |
| D. | 2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑ |
14.能正确表示下列反应的离子方程式是( )
| A. | 将SO2通入Fe3+溶液中:2Fe3++SO2+2H2O═2Fe2++SO42-+4H+ | |
| B. | NaClO溶液与FeCl2溶液混合:Fe2++2ClO-+2H2O═Fe(OH)2↓+2HClO | |
| C. | 将氯化亚铁溶液和稀硝酸混合:Fe2++4H++NO3-═Fe3++2H2O+NO↑ | |
| D. | 将磁性氧化铁溶于盐酸:Fe3O4+8H+═3Fe3++4H2O |
18.0.1mol某饱和一元醇充分燃烧,生成的产物通过碱石灰,使其增重26.6g,该醇不能进行催化氧化反应,则该醇( )
| A. | 2-丙醇 | B. | 2-丁醇 | C. | 1-戊醇 | D. | 2-甲基-2-丙醇 |
15.用100mL2mol/L稀硫酸与过量铁片反应制取氢气时,下列措施能使氢气的生成的速率增大而产生氢气的量不变的是( )
| A. | 给反应体系适当加热 | B. | 向反应体系中加水稀释 | ||
| C. | 加入少量氧化铜固体 | D. | 加压 |
12.化学与生产、生活、环境等息息相关,下列有关说法中正确的是( )
| A. | 双氧水、高锰酸钾溶液可以杀灭病毒,其消毒原理与二氧化硫漂白丝织物原理相同 | |
| B. | 工业上生产玻璃、水泥、漂白粉及用铁矿石冶炼铁,均需要用石灰石为原料 | |
| C. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| D. | 石油分馏、海水晒盐、燃煤烟气的脱硫、从菜籽中提取菜籽油等过程都是物理变化 |
13.关于乙酸的说法错误的是( )
| A. | 能与水互溶 | B. | 能与NaHCO3反应 | ||
| C. | 能发生酯化反应 | D. | 能与甲烷发生反应 |
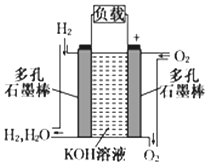 被誉为改变未来世界十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点.如下图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题:
被誉为改变未来世界十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点.如下图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题: