题目内容
7.草酸亚铁晶体(化学组成为FeC2O4•2H2O)是一种淡黄色晶体粉末,是生产锂电池的原材料.已知FeC2O4•2H2O在300℃左右完全分解生成FeO、CO2、CO、H2O四种氧化物.某学习小组欲验证草酸亚铁晶体的分解产物.I.甲组同学设计了如下实验装置:
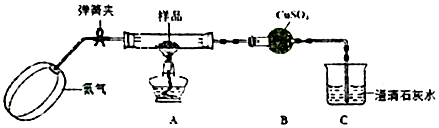
(1)实验开始前,鼓入氮气的目的是排尽装置中的空气,以免生成的FeO被氧化.
(2)实验中,装置B中的现象是白色固体变为蓝色.
(3)设计实验验证装置A中黑色残留物不含有Fe3O4取少量装置A中固体残留物于试管中,加入稀硫酸,振荡加速溶解(必要时加热),滴加KSCN溶液,溶液不显红色,说明固体残留物中不含Fe3O4(简要说明实验操作,现象和结论).
II.乙组同学选用甲组实验中的装置A(接口用x表示)和如图所示的装置(可以重复选用)验证分解产物CO.
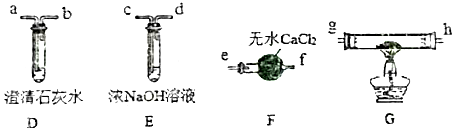
(4)乙组同学的实验装置中,依次连接的合理顺序为x→c→d→a→b→e→fg→h→a(用接口字母和“→”表示).装置G反应管中盛有的物质是CuO(或Fe2O3).能证明草酸晶体分解产物中有CO的现象是G中的粉末由黑色变为红色(或由红棕色变为黑色),D中石灰水变浑浊.
(5)按照题目提供的装置和要求设计的实验明显存在的一个不足是未对尾气进行处理,可造成环境污染.
分析 I.甲组同学设计了如下实验装置;
(1)实验开始前,鼓入氮气的目的是排尽装置中的空气;
(2)分解产物生成水,遇到无水硫酸铜变蓝色;
(3)检验四氧化三铁存在,可以加酸溶解后加入KSCN溶液,若不变红色证明无四氧化三铁;
II.乙组同学选用甲组实验中的装置A(接口用x表示)和如图所示的装置(可以重复选用)验证分解产物CO.
(4)装置A中FeC2O4•2H2O在300℃左右完全分解生成FeO、CO2、CO、H2O四种氧化物,通过装置E中农氢氧化钠溶液吸收二氧化碳,通过装置D检验二氧化碳是否除净,通过装置F中无水氯化钙干燥气体,通过装置G加热一氧化碳和氧化铜反应生成二氧化碳,再通入装置D中检验二氧化碳气体的生成;能证明草酸晶体分解产物中有CO的现象是G中黑色变化为红色,装置D中出现浑浊现象;
(5)装置中无尾气吸收装置.
解答 解:I.甲组同学设计了如下实验装置;
(1)实验开始前,鼓入氮气的目的是排尽装置中的空气,以免生成的FeO被氧化,
故答案为:排尽装置中的空气,以免生成的FeO被氧化;
(2)实验中,装置B中的现象是白色固体变为蓝色,
故答案为:白色固体变为蓝色;
(3)设计实验验证装置A中黑色残留物不含有Fe3O4 ,取少量装置A中固体残留物于试管中,加入稀硫酸,振荡加速溶解(必要时加热),滴加KSCN溶液,溶液不显红色,说明固体残留物中不含Fe3O4,
故答案为:取少量装置A中固体残留物于试管中,加入稀硫酸,振荡加速溶解(必要时加热),滴加KSCN溶液,溶液不显红色,说明固体残留物中不含Fe3O4;
(4)装置A中FeC2O4•2H2O在300℃左右完全分解生成FeO、CO2、CO、H2O四种氧化物,通过装置E中农氢氧化钠溶液吸收二氧化碳,通过装置D检验二氧化碳是否除净,通过装置F中无水氯化钙干燥气体,通过装置G加热一氧化碳和氧化铜反应生成二氧化碳,再通入装置D中检验二氧化碳气体的生成;能证明草酸晶体分解产物中有CO的现象是G中黑色变化为红色,装置D中出现浑浊现象,乙组同学的实验装置中,依次连接的合理顺序为:x→c→d→a→b→e→f→g→h→a,装置G反应管中盛有的物质是:CuO,
能证明草酸晶体分解产物中有CO的现象是G中的粉末由黑色变为红色(或由红棕色变为黑色),D中石灰水变浑浊,
故答案为:c→d→a→b→e→f;CuO;G中的粉末由黑色变为红色(或由红棕色变为黑色),D中石灰水变浑浊;
(5)按照题目提供的装置和要求设计的实验明显存在的一个不足是:未对尾气进行处理,可造成环境污染,
故答案为:未对尾气进行处理,可造成环境污染.
点评 本题考查性质实验方案的设计,为高频考点,把握物质的性质、发生的反应、实验装置的作用等为解答的关键,侧重分析与实验能力的考查,注意排除干扰再利用性质检验CO,题目难度中等.

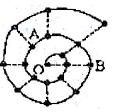 某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个“•”代表一种元素,其中O点代表氢元素.下列说法中错误的是( )
某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个“•”代表一种元素,其中O点代表氢元素.下列说法中错误的是( )| A. | A、B组成的化合物中不可能含有共价键 | |
| B. | 虚线相连的元素处于同一族 | |
| C. | B元素是图中金属性最强的元素 | |
| D. | 离O点越远的元素原子半径越大 |
| A. | 2-丙醇 | B. | 2-丁醇 | C. | 1-戊醇 | D. | 2-甲基-2-丙醇 |
| A. | 给反应体系适当加热 | B. | 向反应体系中加水稀释 | ||
| C. | 加入少量氧化铜固体 | D. | 加压 |
| A. | 双氧水、高锰酸钾溶液可以杀灭病毒,其消毒原理与二氧化硫漂白丝织物原理相同 | |
| B. | 工业上生产玻璃、水泥、漂白粉及用铁矿石冶炼铁,均需要用石灰石为原料 | |
| C. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| D. | 石油分馏、海水晒盐、燃煤烟气的脱硫、从菜籽中提取菜籽油等过程都是物理变化 |
| A. | 为了给人类一个美好蓝天,化工企业推进脱硫、脱硝、除尘等设施改造,能大量减排SO2、NO2 | |
| B. | “PM2.5”是指大气中直径小于或等于2.5×10-6m的细小颗粒物,这些颗粒扩散在空气中形成胶体 | |
| C. | 实验场所严禁携带食物;禁止用饮料瓶装化学药品,防止误食 | |
| D. | 西非国家爆发的埃博拉疫情呈加速蔓延之势,已知该病毒对化学药品敏感,双氧水、“84”消毒液均可以将病毒氧化而达到消毒的目的 |

已知:Cu2O+2H+═Cu+Cu2++H2O
| 沉淀物 | Cu(OH)2 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 5.4 | 4.0 | 1.1 | 5.8 |
| 沉淀完全pH | 6.7 | 5.2 | 3.2 | 8.8 |
(2)反应Ⅰ完成后,铁元素的存在形式为Fe2+.(填离子符号)请写出生成该离子的离子方程式2Fe3++Cu=2Fe2++Cu2+.
(3)沉淀B可用于制造铁红,为了保证铁红的质量则x的取值为3.2≤X<4.0.
(4)书写出由沉淀C制备铝的化学方程式:2Al(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3H2O、2Al2O3$\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$4Al+3O2↑.
 有机物 A 是一种纯净的无色黏稠液体,易溶于水.为研究 A 的组成与结构,进行了如下实验,实验步骤:
有机物 A 是一种纯净的无色黏稠液体,易溶于水.为研究 A 的组成与结构,进行了如下实验,实验步骤: .
. 其中醛基(-CHO)可以用银氨溶液来检验.配制银氨溶液的方法是:向稀的AgNO3溶液中逐滴滴入稀氨水至使最初产生的白色沉淀刚好完全溶解.回答下列各题:
其中醛基(-CHO)可以用银氨溶液来检验.配制银氨溶液的方法是:向稀的AgNO3溶液中逐滴滴入稀氨水至使最初产生的白色沉淀刚好完全溶解.回答下列各题: